
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
分析 A.光导纤维成分为二氧化硅,二氧化硅是酸性氧化物;
B.镀锌或镀锡,镀层破损后形成原电池反应,镀锌形成原电池,锌做负极保护铁,镀锡形成原电池,铁做负极被腐蚀;
C.四氯化碳是一种灭火剂;
D.油脂在氢氧化钠溶液中能发生皂化反应生成硬脂酸钠;
解答 解:A.光导纤维成分为二氧化硅,二氧化硅是酸性氧化物,和碱溶液反应生成盐和水,光导纤维应避免在强碱环境中使用,故A正确;
B.镀锌或镀锡,镀层破损后形成原电池反应,镀锌形成原电池,锌做负极保护铁,镀锡形成原电池,铁做负极被腐蚀,镀层破损后将立即失去保护作用的是镀锡层,故B错误;
C.四氯化碳是卤代烃,可做灭火剂,故C正确;
D.油脂在NaOH溶液中发生皂化反应生成硬脂酸钠,硬脂酸钠用于制造肥皂,所以肥皂的主要成分是硬脂酸钠,故D正确;
故选B.
点评 本题考查了化学与生活,明确物质的性质是解本题关键,根据物质的性质分析解答,会运用化学知识解释生活现象,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
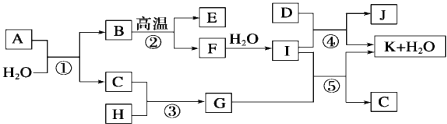
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
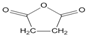 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(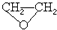 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.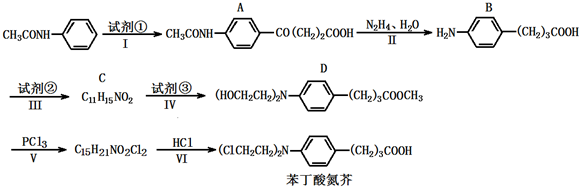
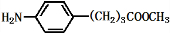
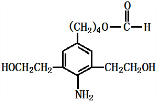
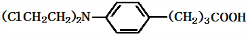 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$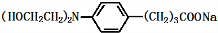 +2NaCl+H2O
+2NaCl+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
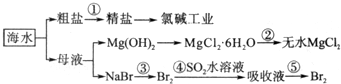
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
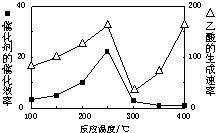 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com