
分析 依据在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP=c(Ag+)•c(Cl-)=1.8×10-10,温度不变,Ksp不变,c(Cl-)越小,则c(Ag+)越大,结合Ksp计算银离子浓度,
解答 解:(1)KSP=c(Ag+)•c(Cl-)=1.8×10-10,c(Cl-)越小,则c(Ag+)越大,由题给数据可知题中c(Cl-)由小到大的顺序为A<B<D<C,则c(Ag+)最大的是A,
故答案为:A;
(2)在0.10mol/LAlCl3溶液中,c(Cl-)=0.3mol/L,则c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.3}$mol/L=6×10-10mol/L,
故答案为:6×10-10mol/L.
点评 本题考查了难溶物质的沉淀溶解平衡的应用,溶度积的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
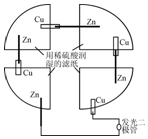 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(A-N-2)}{A}$ mol | B. | $\frac{n(A-N+8)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N+2)}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
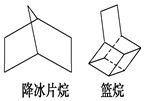 如图都是简化的碳架结构:
如图都是简化的碳架结构:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | AgCl沉淀多于AgBr沉淀 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl和AgBr沉淀等量生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
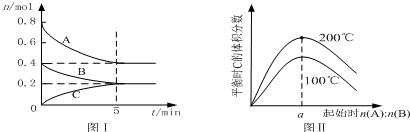
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O═Al (OH)3↓+3NH4+ | |
| C. | 硫氢化钠水解:HS-+H2O?H2S+OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com