
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ、某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
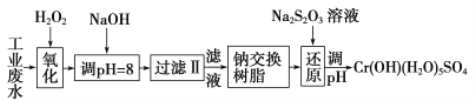
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是_________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是________(填序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+ E.Fe2+
Ⅱ、酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?____(填“能”或“不能”)。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为:________________________。
【答案】 A AC BD 不能 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4。
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;故答案为:AC;BD;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,故答案为:不能;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在周期表中的相对位置如表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙>丁>戊
B.最外层电子数:甲>乙
C.金属性:甲<丙
D.氢氧化物碱性:丙>丁>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸需经过SO2的制造、SO2的催化氧化和SO3的吸收三个主要阶段,下列说法错误的是( )
A.废渣可做建材B.将矿石粉碎增大反应速率
C.尾气直接排放D.热交换器提高能量利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中是食用碘盐包装上的部分说明,下列说法正确的是配料( )
配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A. 高温会导致碘的损失 B. 碘酸钾可氧化氯化钠
C. 可用淀粉检验碘盐中的碘酸钾 D. 该碘盐中碘含量是指碘酸钾的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键也可能是共价键
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
下列说法不正确的是
A. H2A的电离方程式为:H2A==H++HA- HA-![]() A2-+H+
A2-+H+
B. 室温下,电离平衡HA-![]() A2-+H+的平衡常数Ka=10-3。
A2-+H+的平衡常数Ka=10-3。
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与醋酸有关的反应方程式正确的是
A. 与烧碱反应:OH-+CH3COOH → CH3COO-+H2O
B. 与CaCO3反应:CO32-+2CH3COOH → 2CH3COO-+CO2↑+H2O
C. 乙醛氧化:CH3CHO+O2 ![]() CH3COOH
CH3COOH
D. 制乙酸乙酯:CH3COOH+C2H518OH ![]() CH3COOC2H5+H218O
CH3COOC2H5+H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化合物】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

已知:
请回答:
(1)写出下列反应方程式
①B+D→E______________________________________。
②G→H________________________________________。
(2)①的反应类型为__________;②的反应类型为__________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com