
【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。
【答案】实验3 29.4%
【解析】
由于杂质难溶于水且不与酸反应,故粗锌与稀硫酸的反应,为锌与稀硫酸的反应;根据实验1和2可知:加入8g粗锌生成0.2g氢气,反应后剩余1.5g固体,加入16g粗锌生成0.4g氢气,反应后剩余3.0g固体,说明实验1反应后,酸过量,实验2中锌也完全反应;而且每增加8g粗锌应增加0.2g氢气,从实验3数据可知,生成氢气的质量应该大于0.6g,实际为0.6g,说明锌过量,稀硫酸不足;据此分析解答。
(1)根据上述分析,实验1和2中锌完全反应,酸过量,实验3中锌过量,稀硫酸不足,稀硫酸反应完的是实验3,故答案为:实验3;
(2)实验3中稀硫酸完全反应,设稀硫酸的溶质质量分数为x,
Zn+H2SO4═ZnSO4+H2↑
98 2
100g×x 0.6g
![]() =
=![]() ,解得:x=29.4%,故答案为:29.4%。
,解得:x=29.4%,故答案为:29.4%。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。

下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。实验步骤如下:
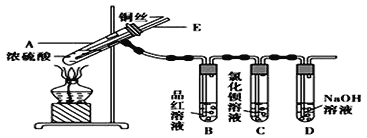
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为__________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_____。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将实验后的溶液分成两份,分别滴加氯水和氨水,均产生白色沉淀。写出其中SO2表现还原性的离子反应方程式为_____。
(4)下列对导管E作用的分析中正确的是__________。
A 加热过程中,可上下移动导管E,起搅拌作用
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸
C 停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO2气体,防止其污染环境
II ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图1装置(夹持装置略)对ClO2的制备、除杂、吸收和释放等进行了研究。

(1)仪器B的名称是________。打开B的活塞,A中发生反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加B中稀盐酸的速度宜______(填“快”或“慢”)。
(2)关闭B的活塞,ClO2在D中被某种稳定剂完全吸收生成NaClO2,此时F中溶液颜色不变,则装置C的作用是____。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____;在ClO2释放实验中,打开E的活塞,D中发生反应,则此时装置F的作用是_____。安装F中导管时,应选用图2中的____(填“a”或“b”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛一铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的价电子排布图为___________。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为___________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要___________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯三甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有___________个π键。
②在丙醛( CH3CH2CHO)分子中碳原子的杂化方式分别为___________。
③C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为______________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与VO43-空间构型相同的一种阴离子:___________(填离子符号)。
(4)已知单质钒的晶体采用体心立方堆积,晶胞如上图4所示,假设钒原子直径为d×10-7cm,钒的相对原子质量为M,则晶体密度的表达式为___________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):

分析图象,回答下列问题:
(1)在图象反应Ⅰ中,此正反应为________(填“吸热”或“放热”)反应,若p1>p2,则此反应的△S________0(填“>”或“<”),由此判断,此逆反应自发进行,必须满足的条件是____________.
(2)在图象反应Ⅱ中,T1_____T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T1<T2,则该反应_______(填“能”或“不能”)自发进行.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)![]() C2H4(g)+2H2O(g) ΔH1
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:

下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ΔH = -5.2 kJ·mol-1
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A可发生如图所表示的反应:
写出相应物质的化学式和类别(填在表格内),并依次写出各步反应的化学方程式。
A | B | C | D | E | |
化学式 | Cu | CuCl2 | ____ | ____ | ____ |
类 别 | _____ | _____ | 碱 | 氧化物 | 盐 |
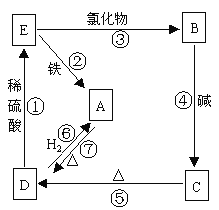
(1)______________________________。
(2)______________________________。
(3)______________________________。
(4)______________________________。
(5)______________________________。
(6)______________________________ 。
(7)______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com