
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
分析 由反应可知,Zn元素的化合价升高,则N元素的化合价降低,结合电子与原子守恒计算.
解答 解:由反应可知,Zn元素的化合价升高,则N元素的化合价降低,
①若M为NO2,由电子守恒可知,b=$\frac{4×(2-0)}{(5-4)}$=8,A、B错误;
②若M为NO,由电子守恒可知,b=$\frac{4×(2-0)}{(5-2)}$=$\frac{8}{3}$,D错误;
③若M为NH4NO3,由电子守恒可知,b=$\frac{4×(2-0)}{[5-(-3)]}$=1,结合原子守恒可知,a=4,c=3,
故选C.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算考查,注意电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
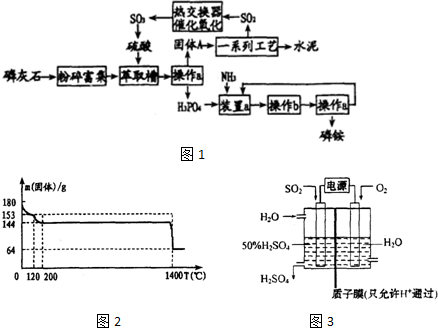
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
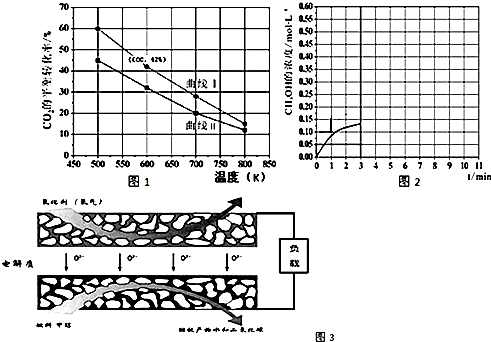
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应将混合物中的水分蒸干后,才能停止加热 | |
| B. | 用Ba(NO3)2溶液鉴别Cl-、SO42和CO32- | |
| C. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| D. | 可以用溶解过滤的方法从加热氯酸钾和二氧化锰的混合物中获得二氧化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
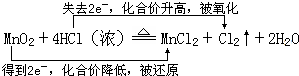
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
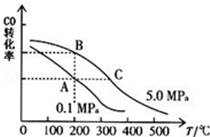 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 1molAl3+含有核外电子数为3NA | |
| C. | 常温常压下,1mol氧气所含的原子数为NA | |
| D. | 1molNaCl晶体中含有NA个Na+和NA个Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com