
| A. | 1.00 mol•L-1 | B. | 0.500 mol•L-1 | C. | 2.00 mol•L-1 | D. | 3.00 mol•L-1 |
分析 Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=$\frac{n}{V}$计算盐酸的浓度.
解答 解:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,
向反应后溶液中加入NaOH溶液,得到的沉淀最多,应满足恰好反应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,
根据钠离子守恒可得:n(NaCl)=n(NaOH)=0.250L×2.00mol/L=0.5mol,
根据氯离子守恒可得:n(HCl)=n(NaCl)=0.5mol,
故该元素的物质的量浓度=$\frac{0.5mol}{0.5L}$=1mol/L,
故选A.
点评 本题考查了有关混合物反应的计算,题目难度中等,注意掌握质量守恒定律在化学计算中的应用方法,本题中明确反应后的溶质组成为解答关键,试题侧重考查学生的分析、理解能力.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题

 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.
“摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁溶液中加入足量的烧碱:HCO3-+OH-=CO32-+H2O | |
| B. | 铝粉投入到烧碱溶液中:Al+2OH-=AlO2-+H2↑ | |
| C. | 铁粉加到足量的稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向FeSO4和KSCN溶液滴加酸化的H2O2溶液,立即变红:2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
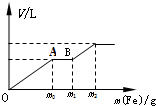 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)| 实验编号 | 水果种类 | 电极间距离 | 电流大小/μA |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹果 | 2 | 27.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com