
����Ŀ��X��Y��Z��W �Ƕ���������Ԫ�أ�X ԭ�����������������ڲ�������� 3 ����Y ��ԭ���������������������� 6 ����Z ��һ�ֵ�������Ȼ������Ӳ�����ʣ���Ȼ���У�W �ĵ��ʶ�����ڻ�ɽ�ڸ�������Ϊ����ɫ���塣����������ȷ����
A. ԭ�Ӱ뾶�Ĵ�С��Z>X > Y
B. W ���⻯��ķе�� X �ĸ�
C. Y �ĵ��ʿ�ͨ�����ȷ�Ӧұ��
D. W ������������Ӧˮ�����������ͬ��������ǿ
���𰸡�D
��������
X��Y��Z��W�Ƕ���������Ԫ��,Xԭ�����������������ڲ��������3��,XΪOԪ��;Y��ԭ����������������������6��,��Y������������Ϊ2,ԭ������Ϊ12,��YΪMgԪ��;Z��һ�ֵ�������Ȼ������Ӳ������,ZΪCԪ��;��Ȼ����,W�ĵ��ʶ�����ڻ�ɽ�ڸ���,��Ϊ����ɫ����,WΪS,�Դ������
A.���Ӳ�Խ��,ԭ�Ӱ뾶Խ��,ͬ���ڴ�������ԭ�Ӱ뾶��С,��ԭ�Ӱ뾶�Ĵ�С:Y![]() Z
Z![]() X����A����;��
X����A����;��
B.W���⻯����H2S��X���⻯����H2O����ΪH2O���Ӽ������������H2O�ķе��H2S�ķе�ߣ���B����
C.���ȷ�Ӧ����ұ�����۵���������緰�������̣��٣�����ұ���������õģ�����þ����C����
D.W������������Ӧˮ����Ϊ���ᣬ����������Ӧˮ�����������ͬ��������ǿ����D��ȷ��
�����ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��ͨ���ⶨ��Ӧ���������ų��������������к��ȡ�����50mL0.5mol/L ��������50mL0.55mol/L �� NaOH ��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ�� ��ش��������⣺
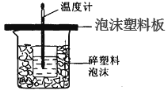
(1)��ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��_________����ͼ��֪��װ ���в���֮����Ӧ��θ�����_____��
(2)ʵ���и��� 60 mL0.50 mol/L ������� 50mL 0.55 mol/L �� NaOH ��Һ���з�Ӧ���� ����ʵ����ȣ����ų�������_____(��������������������)�������к��ȵ���ֵ��_____(����������� ���������)��������_____��
(3)��ͬѧ��ʵ��ʱ��Щ�������淶����ɲ���к��ȵ���ֵƫ�ͣ�����������ܵ�ԭ�� ��_____��
A������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ� B������Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ� C������ʵ��ĵ������½ϸ� D������ȡ����ʱ���Ӽ���
E���� 50mL0.55mol/L ����������Һȡ���� 50mL0.55mol/L �İ�ˮ
(4)�� V1ml 1.0mol/L HCl ��Һ�� V2ml δ֪Ũ�ȵ� NaOH ��Һ��Ͼ��Ⱥ��������¼�� �ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ��� V1+V2=50mL)
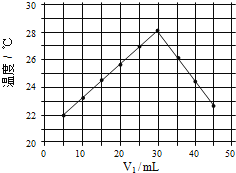
ͨ������ͼ���֪������ʵ��ʱ�����¶�_____(������������������������������)22�棬�� NaOH ��Һ��Ũ��ԼΪ_____mol/L��
(5)�������������������Һ���ܶȶ��� 1g��cm��3����֪�кͷ�Ӧ��������Һ�ı����� c��4.18J��g��1������1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ����� | ��ʼ�¶� t1/�� | ��ֹ�¶� t2/�� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��_____(�������һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������õIJ��ֹ�����ͼ��ʾ������˵��������ǣ� ��
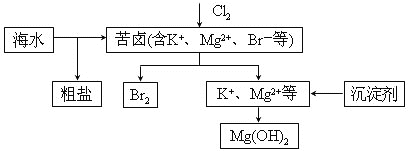
A. ���±��ͨ��Cl2��Ϊ����ȡ��
B. ��ҵ�����г�ѡ��NaOH��Ϊ������
C. ���οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
D. ������һ�����ÿ�����ˮ�������������壬����![]() ���仹ԭ����
���仹ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2(g)+B2(g)![]() 2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
��1���ﵽƽ��ʱ�� A2��ת����Ϊ____________��
��2���ﵽƽ�������ԭ������ͨ�������������A2��ת���ʽ�________(���������С�����䡱)
��3������ԭ���������У�ֻ����2mol C3��500��ʱ��ַ�Ӧ��ƽ�����������Q3 kJ��C3Ũ��___(��>��=��<)w mol��L��1��Q1��Q2��Q3 ֮��������ֹ�ϵ��Q3=____________��
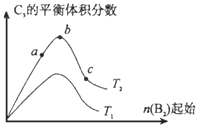
��4���ı�ijһ�������õ���ͼ�ı仯����(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)���ɵó��Ľ�����ȷ����____________��
a����Ӧ����c��b��a
b���ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c
c��T2��T1
d��b��A2��B2�����ʵ���֮��Ϊ2��1
��5����������������Ϊ��ѹ����������ʼʱ����4 molA2��2 molB2��500��ʱ��ַ�Ӧ��ƽ��ų�����Q4 kJ����Q2__________Q4(�>������<����=��)��
��6�����д�ʩ����ͬʱ��߷�Ӧ���ʺ�B2��ת������___________(��ѡ�����)��
a��ѡ���ʵ��Ĵ��� b������ѹǿ
c����ʱ�������ɵ�C3 d�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ����ͼ����֪����1mol N��N������942kJ����������1molN��N���ͷ�167kJ��������������Ϣ�����ݣ������Ȼ�ѧ����ʽ��ȷ����
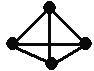
A. 2N2 = N4 ��H = ��882kJ��mol-1
B. N2 (g) = 0.5N4 (g) ��H = +441kJ
C. N2 (g) = 0.5N4 (g) ��H = ��441kJ��mol-1
D. 2N2(g) = N4(g) ��H = +882 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������״ͬ���칹����Ŀ������(��)
A.����B.��ϩ(C4H8)C.����D.���ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ������ȷ��ʾ��ط�Ӧ�в������ʵ����ı仯���ǣ��ᡢ�����굥λ��mol��

A. ͼl��n��HCl��=lmol��K2CO3���뵽HCl��Һ�У��ڳ������������ɵ�����
B. ͼ2��n��NaOH��="1" mol��CO2��ͨ�˵�NaOH��Һ�з�Ӧ���ɵ���
C. ͼ3��n��O2��=1mol��������C��O2���ܱ������еķ�Ӧ����
D. ͼ4��n��HNO3����=lmol��Fe��ϡHNO3��Ӧ���ɵ����������ԭ����ΪNO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������ȷ���ܴﵽĿ�ĵ��ǣ�
A. ����̼���ƺ�̼������ 
B. ��ȡ100.00mL��Һ 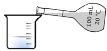
C. �Ƶ�ȼ��
D. ʵ������ȡ����ˮ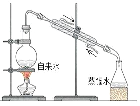
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�г���ͼ��ֱ�۵�������ѧ��Ӧ�Ľ��̻���������ͼ��������ȷ����
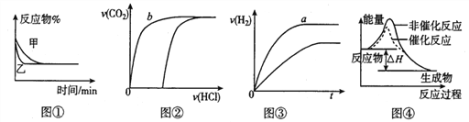
A. ͼ����ʾ��ͬѹǿ�Կ��淴Ӧ2A(g)+2B(g)![]() 3C(g)+D(s)��Ӱ��
3C(g)+D(s)��Ӱ��
B. ͼ����ʾ��10ml0.1mol��L-1Na2CO3��NaHCO3������Һ�зֱ�μ�0.lnol��L-1HCl��Һʱ��CO2���������������ı仯����b��ʾ����NaHCO3��Һ
C. ͼ����ʾ�����pH����ͬ��HCl��CH3COOH������Һ�У��ֱ����������п������H2�������ʱ��ı仯����a��ʾ����HCl��Һ
D. ͼ����ʾ�÷�ӦΪ���ȷ�Ӧ���Ҵ����ܸı䷴Ӧ���ʱ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com