
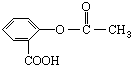
 ,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下:
,它可以接在一种高聚物载体上形成缓释长效药剂.其中的一种结构如下: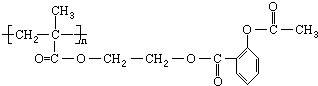
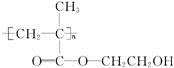 .
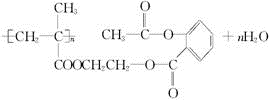
.
 .
.分析 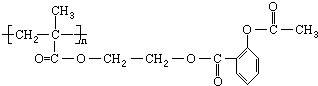 由
由 和高聚物载体发生缩聚反应生成,该高聚物载体为
和高聚物载体发生缩聚反应生成,该高聚物载体为 ,对应单体为CH2=C(CH3)COOCH2CH2OH,以此解答该题.
,对应单体为CH2=C(CH3)COOCH2CH2OH,以此解答该题.
解答 解: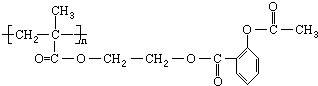 由
由 和高聚物载体发生缩聚反应生成,该高聚物载体为
和高聚物载体发生缩聚反应生成,该高聚物载体为 ,对应单体为CH2=C(CH3)COOCH2CH2OH,
,对应单体为CH2=C(CH3)COOCH2CH2OH,
(1)由以上分析可知高聚物载体为 ,故答案为:
,故答案为: ;
;
(2)缓释长效阿司匹林水解生成阿司匹林和 ,反应方程式为
,反应方程式为
 ,
,
故答案为:
 ;
;
(3) 为加聚产物,对应单体为CH2=C(CH3)COOCH2CH2OH,
为加聚产物,对应单体为CH2=C(CH3)COOCH2CH2OH,
故答案为:CH2=C(CH3)COOCH2CH2OH.
点评 本题考查有机物结构和性质,为高频考点,侧重考查反应类型判断及方程式的书写,明确官能团及其性质关系即可解答,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质的分子内不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | NaCl晶体熔化,需要破坏离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和二氧化硅都属于原子晶体 | |
| B. | 分子晶体的状态变化,只需克服分子间作用力 | |
| C. | 金属晶体通常具有导电、导热性能和良好的延展性 | |
| D. | 离子晶体在熔化状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
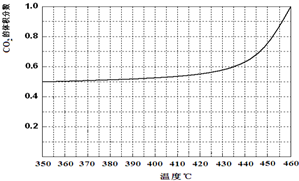
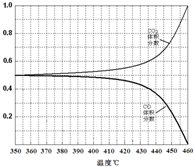 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去溴苯中的溴:加入CCl4后分液 | |
| B. | 除去乙醇中的乙酸:加入NaOH溶液后分液 | |
| C. | 除去乙烷中的乙烯:加入氢气后在一定条件下充分反应 | |
| D. | 除去苯甲醛中的苯甲酸:加入生石灰后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com