
分析 (1)根据盖斯定律结合已知热化学方程式构造出目标反应的热化学方程式;
(2)①依据1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能分析;
②依据热化学方程式和盖斯定律计算得到.
解答 解:(1)解:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ/mol ①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ/mol ③
①×3-②-③×2得:
6CO(g)+6FeO(s)═6Fe(s)+6CO2(g)△H=(-25kJ/mol)×3-(-47kJ/mol)-(+19kJ/mol)×2=-66kJ/mol,
即 CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol
故答案为:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol;
(2)①1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能,则表示出氯化钠晶体晶格能的热化学方程式为:Na+(g)+Cl-(g)═NaCl(s);△H;所以A正确;
故答案为:A;
②A.Na+(g)+Cl-(g)→NaCl(s);△H
B.Na(s)+$\frac{1}{2}$Cl2(g)→NaCl(s);△H1
C.Na(s)→Na(g);△H2
D.Na(g)-e-→Na+(g);△H3
E.$\frac{1}{2}$Cl2(g)→Cl(g);△H4
F.Cl(g)+e-→Cl-(g);△H5
依据盖斯定律A+C+D+E+F得到:Na(s)+$\frac{1}{2}$Cl2(g)→NaCl(s)△H1=△H+△H2+△H3+△H4+△H5,
故答案为:△H1=△H+△H2+△H3+△H4+△H5.
点评 本题考查了盖斯定律在热化学方程式中的应用,题目难度中等,明确盖斯定律的概念及应用方法为解答关键,注意掌握晶格能的概念、热化学方程式的书写原则.


科目:高中化学 来源: 题型:选择题
| A. | 酚遇FeCl3溶液时立即显紫色,而醇不能 | |
| B. | 分子内有苯环和羟基的化合物一定是酚 | |
| C. | 含有羟基的化合物一定是醇 | |
| D. | 酚和醇具有相同的官能团,因而具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| C. | 深入农村和社区宣传环保知识 | |
| D. | 按照规定对生活废弃物进行分类放置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +5 | C. | +4 | D. | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
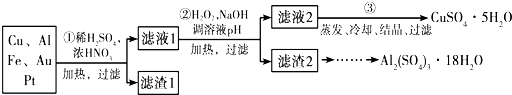

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com