
分析 (1)铵根离子水解,使溶液呈酸性,一般情况下盐的水解程度都比较小;
(2)一水合氨为弱电解质,不能完全电离,加水促进电离;
(3)①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,
c(Ag+)依据Ksp(AgCl)计算得到,
②溶液PH=-lgc(H+);
(4)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-.
解答 解:(1)铵根离子水解,使溶液呈酸性,用离子方程式表示为NH4++H2O=NH3•H2O+H+,一般情况下盐的水解程度都比较小,所以溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O=NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(3)①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,
n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol;
反应后剩余的Cl-为0.1×10-3 mol,
则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,
c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol•L-1.
故答案为:1.0×10-7 mol•L-1;
②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol•L-1,pH=2,故答案为:2;
(4)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
点评 本题考查盐的水解、弱电解质的电离平衡的影响,溶度积常数计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
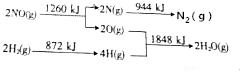
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cu2+、Cl-、SO42- | B. | HCO3-、NO3-、SO42-、Na+ | ||
| C. | Cl-、SO42-、K+、Na+ | D. | Fe3+、SO42-、Cl-、Al[(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可得到丙三醇 | |
| B. | 麦芽糖水解只生成葡萄糖 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 钠长期放置在空气中,最终将变成碳酸钠 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 冰水混合物 | CuSO4•5H2O | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 酒精 |
| C | 液氯 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com