
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________,得到滤渣 1的主要成分为_______________。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________。
(4)第③步蒸发所需玻璃仪器为__________________。
【答案】Cu+4H++2NO3-=Cu2+ +2NO2↑+2H2O Au、Pt 不引入新的杂质,对环境无污染 Al(OH)3+OH- =AlO2-+2H2O 酒精灯、玻璃棒
【解析】
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+离子进入溶液;Pt和Au不能反应,仍以固体单质的形式存在,所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2+ +2NO2↑+2H2O;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式为2H++2Fe2++H2O2=2Fe3++2H2O。用H2O2作氧化剂的优点是还原产物是H2O,不引入杂质,且对环境无污染;
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中可根据Al(OH)3是两性氢氧化物,能够与强碱NaOH溶液反应,而Fe(OH)3是碱,不能与强碱发生反应来分离两种难溶性物质,反应的离子方程式为Al(OH)3+OH- =AlO2-+2H2O;
(4)第③步从含有CuSO4的溶液中获得CuSO45H2O晶体的方法是蒸发结晶法,蒸发时所需玻璃仪器为酒精灯、玻璃棒。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1 mol·L1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶1,则Cu2+与原溶液中的Fe3+的物质的量之比为( )
A. 4∶1 B. 1∶4 C. 1∶6 D. 6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能量的转化过程中,由化学能转化为电能的是
A. 车载铅蓄电池启动B. 二滩电站水力发电
C. 西区竹林坡光伏(太阳能)发电D. 米易县龙肘山风力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯![]() 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
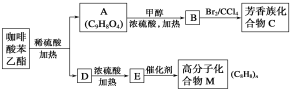
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:_________________________。A→B的反应类型为__________。
(4)E→M的反应方程式为_____________________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是

A. 原子半径:A<B<C<D
B. A、B分别与D形成的化合物均为离子化合物
C. B、C的简单离子都会影响水的电离平衡
D. 乙在浓氨水中能溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列反应属于氧化还原反应的是
A.CaO+H2O=Ca(OH)2
B.2Mg + O2 ![]() 2MgO
2MgO
C.Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑
D.Cu(OH)2![]() CuO + H2O
CuO + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:___________________________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为________L,转移的电子数为_________个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体______g。
(3)将标准状况下6.72L的HCl溶于水形成250mL溶液,取出10mL于锥形瓶中,溶质的物 质的量浓度为______mol/L,向锥形瓶中滴加0.5mol/LBa(OH)2溶液,恰好反应,消耗Ba(OH)2的体积为__________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com