
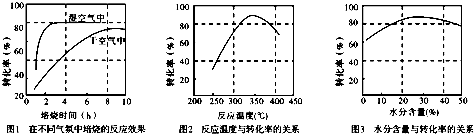
| C2(CO2) |
| C(O2) |
| C2(CO2) |
| C(O2) |
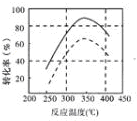 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、5.4.3 |
| B、4.4.3 |
| C、4.3.2 |
| D、3.3.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
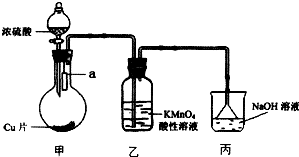 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
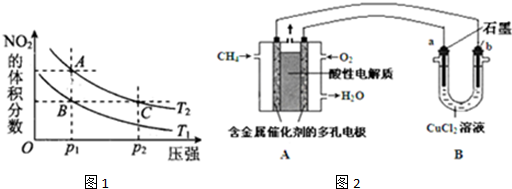
| c(H+) |
| c(HA) |
| c(HA) |
| A- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com