
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
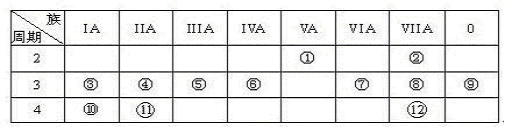
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素描述 |
| A | 单质是最理想的气体燃料;而氧化物是最常用的液态灭火剂 |
| B | 氧化物之一不但能造成酸雨,还能造成光化学烟雾 |
| C | 所处周期数、族序数都与电子层数相等 |
| D | 最高化合价为+7 |
| E | 目前用量最大,应用最广泛的金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.+99.7 mol·L-1 | B.+29.7 mol·L-1 |
| C.-20.6 mol·L-1 | D.-241.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.光纤的主要成分是高纯度的单质硅 | B.刚玉的主要成分是二氧化硅 |
| C.28g硅含有6.02×1023个电子 | D.28Si、29Si、30Si是不同的核素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.②⑤⑥ | C.②⑥ | D.全部都正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com