
| A. | NaOH | B. | MgCl2 | C. | H2O | D. | HCl |
科目:高中化学 来源: 题型:选择题

| A. | 锌锰电池的负极是锌,发生的反应是Zn-2e-═Zn2+ | |
| B. | 普通锌锰电池在使用过程中锌外壳逐渐变薄,最后内部糊状的电解质会泄漏出来 | |
| C. | 碱性锌锰电池的使用寿命和性能都优于普通锌锰电池 | |
| D. | 锌锰电池是二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,产物苯胺还原性强,易被氧化.则由甲苯合成对氨基苯甲酸的合成路线合理的是( )
,产物苯胺还原性强,易被氧化.则由甲苯合成对氨基苯甲酸的合成路线合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中混有少量乙烯,可将混合气体通入盛有酸性高锰酸钾溶液的洗气瓶中除去 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 在苯中加入溴的四氯化碳溶液,振荡并静置后下层液体为无色 | |
| D. | 食物中含有大量的纤维素,可以在人体内直接水解成葡萄糖成为营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ;
; +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+KCl=NaCl+KOH | B. | AgNO3+NaCl=AgCl↓+NaNO3 | ||
| C. | Na2CO3+Ca(OH)2=CaCO3↓+2NaOH | D. | NaOH+NH4NO3=NaNO3+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
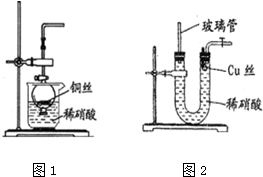
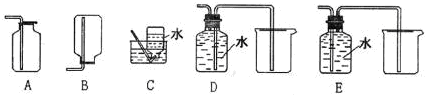
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝放入烧碱溶液中溶解:2Al+2OH-+2 H2O═2 AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 稀硫酸中加氢氧化钡溶液至中性:H++OH-═H2O | |
| D. | NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com