
(14分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++  =
=  Cl-+
Cl-+  Fe3++
Fe3++  .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
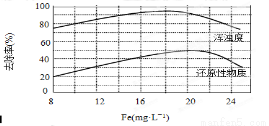
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
下列物质不能与氢氧化钠溶液反应的是
A. Al B.Fe2O3 C.Al(OH)3 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:选择题
有下列仪器:①漏斗;②锥形瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙。其中常用于分离物质的仪器是
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:实验题
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
(2)实验装置(如图所示):
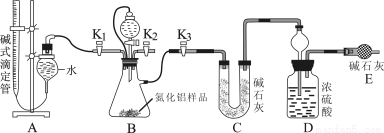
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3 ,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。④ (填入该步应进行的操作)。⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关氯元素及其化合物的表示正确的是
A.质子数为17、中子数为20的氯原子: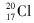
B.氯离子(Cl-)的结构示意图:
C.氯分子的电子式: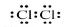
D.氯乙烯分子的结构简式:H3C-CH2Cl
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列化学用语或命名正确的是
A.次氯酸的结构式:H—Cl—O
B.含有10个中子的氧原子的符号: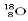
C.S2-的结构示意图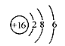
D.NH4Cl的电子式: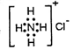
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,石墨烯,金刚石
D.混合物:铝热剂,纯净矿泉水,水玻璃,漂白粉
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:选择题
相同温度下,两个恒压密闭容器中发生可逆反应X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化 | ||
X2 | Y2 | XY3 | ||
① | 0.1 | 0.3 | 0 | 4.63kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0)kJ |
下列叙述正确的是
A.反应的平衡常数:①>②
B.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C.达到平衡时,容器①、②中各物质的百分含量相同
D.若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com