
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.分析 (1)根据物质的量的变化量之比等于计量数之比分析;
(2)温度降低,反应速率的减慢;
(3)根据反应速率之比等于化学计量数之比比较;
(4)根据v=$\frac{△c}{△t}$计算反应速率,结合图象计算相关物理量;
(5)根据可逆反应处于平衡状态时,正逆反应速率相等、组成不变等特征判断.
解答 解:(1)由方程式2NO2 (g) (红棕色)?N2O4g)(无色),可知反应中NO2 的物质的量变化较大,则X表示NO2的物质的量随时间的变化曲线;
故答案为:X;
(2)温度降低,正逆反应速率都减慢;
故答案为:减慢;减慢;
(3)(3)分别测得甲中v(NO2)=0.3mol/(L•s),乙中v(N2O4)=6mol/(L•min),v(NO2)=2v(N2O4)=0.6mol•L-1•min-1=0.01mol/(L•s),则甲反应较快,
故答案为:甲;
(4)分析图象可知在0到3min中内N2O4的物质的量从0.4mol变为0.7mol,则其反应速率v=$\frac{△c}{△t}$=
$\frac{(0.7mol-0.4mol)÷2L}{3min}$=0.05mol/(L•min);
故答案为;0.05mol/(L•min);
(5)A.v(NO2)=2v(N2O4),未体现正与逆的关系,故错误;
B.该反应是个体积变化的可逆反应,容器内压强不再发生变化,说明达平衡状态,故正确;
C.X的体积分数不再发生变化,说明达平衡状态,故正确;
D.容器内气体原子总数不再发生变化,根据质量守恒,从反应发生容器中原子总数就不变,所以不能作平衡状态的标志,故错误;
E. 只要反应发生就符合相同时间内消耗n mol的Y的同时生成2n mol的X,所以不一定达平衡状态,故错误;
F.相同时间内消耗n mol的Y对于X就是生成2n mol,同时又消耗2n mol的X,说明正逆反应速率相等,达平衡状态,故正确;
故答案为:BCF.
点评 本题考查了化学平衡状态的判断,转化率的计算,以及速率快慢的比较,较为综合,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 | |
| B. | 将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性 | |
| C. | 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 | |
| D. | 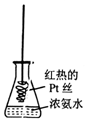 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,Ksp(AgCl)=1.8×10-10,Ksp (Ag2CrO4)=1.9×10-12,故Ag2CrO4更难溶 | |
| B. | 在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 在AgCl饱和溶液中,加入AgCl固体,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
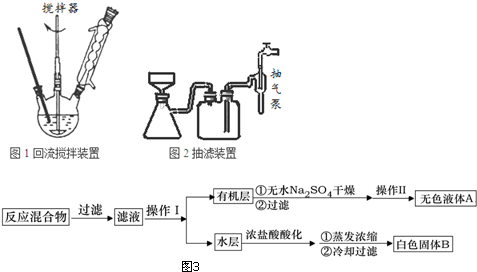
 ;操作Ⅱ为蒸馏.
;操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
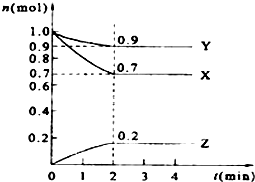 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
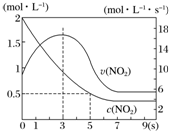 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )| A. | 5s时NO2的转化率为75% | |
| B. | 0~3 s时v(NO2)增大是由于体系温度升高 | |
| C. | 3s时化学反应处于平衡状态 | |
| D. | 9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
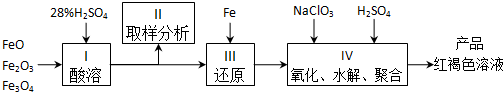
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
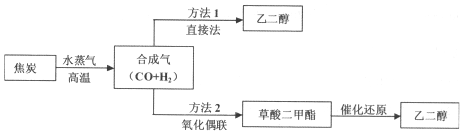
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com