
分析 (1)“绿色化学”是指:化学反应中没有污染性的物质生成、原子利用率高的反应;
(2)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸;
(3)①蔗糖脱水反应生成碳,浓硫酸与碳反应生成二氧化硫、二氧化碳和水;
②二氧化硫具有还原性、二氧化碳没有还原性.
解答 解:(2)①Cu+HNO3(浓)→Cu(NO3)2,反应产生二氧化氮有毒气体,故不选;
②Cu+HNO3(稀)→Cu(NO3)2,反应生成一氧化氮有毒气体,故不选;
③Cu $→_{△}^{空气}$ CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2,反应没有有毒气体生成,硝酸全部转化为硝酸铜,原子利用率高考符合“绿色化学”思想,故选;
故答案为:③;
(2)盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,反应的方程式为Cu+H2O2+2HCl=CuCl2+2H2O;
故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;
(3)蔗糖脱水反应生成碳,浓硫酸与碳反应生成二氧化硫、二氧化碳和水,其反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
②二氧化硫具有还原性能使高锰酸钾、溴水等褪色,二氧化碳没有还原性,不能使高锰酸钾、溴水,可以鉴别二者;
故答案为:高锰酸钾、溴水.
点评 本题考查了Cu、硝酸、浓硫酸性质及其应用,题目难度中等,明确发生反应的原理为解答关键,试题侧重考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | 硫酸铝钾溶液中滴加氢氧化钡直到沉淀质量最大:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| C. | 硫氢化钠发生电离:HS-+H2O═H3O++S2- | |
| D. | 用食醋检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B | C | D |
| A12O3 | Si | Na2O2 | Na2SiO3 |
| 两性氧化物 | 单质 | 碱性氧化物 | 正盐 |
| 工业用电解法冶炼铝 | 制作太阳能电池 | 用于呼吸面具作为氧气的来源 | 制备硅胶 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
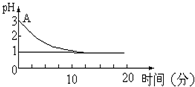 关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:
关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体 | B. | 离子晶体 | C. | 原子晶体 | D. | 以上晶体都不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸铜和铝:2Al+3Cu2+═3Cu+2Al3+ | |
| B. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com