
【题目】①VLFe2(SO4)3中含有Fe3+mg,则SO42-的物质的量浓度为____________
②6.02×1024个Na+约含_______molNa+;4.5mol甲烷约含有_________个分子,其质量为________g;
3.01×1023个CO2在标准状况下体积是________L,它与__________gCO含有相同的氧原子数。
③将4ml37%的盐酸密度为(1.19g·cm-3)加水稀释到200ml,稀释后盐酸的物质的量浓度是__________。
④在标准状况下22.4L由氮气和氧气组成给的混合气体,其质量为30g,则其中氧气的质量为__________g。
⑤同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对体积分子质量为__________。
【答案】①3m/112000V mol/L(不写单位不给分);
②10;2.71×1024;72;11.2,28;③0.24mol/L;④ 16;⑤32
【解析】
试题分析:①VLFe2(SO4)3中含有Fe3+mg,物质的量为![]() ,根据硫酸铁的化学式可知硫酸根的物质的量是
,根据硫酸铁的化学式可知硫酸根的物质的量是![]() ,则SO42-的物质的量浓度为
,则SO42-的物质的量浓度为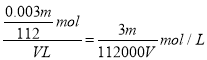 ;
;
②6.02×1024个Na+约含![]() Na+;4.5mol甲烷约含有
Na+;4.5mol甲烷约含有![]() 个分子,其质量为4.5mol×16g/mol=72g;3.01×1023个CO2在标准状况下体积是
个分子,其质量为4.5mol×16g/mol=72g;3.01×1023个CO2在标准状况下体积是![]() 。其中含有1mol氧原子,则它与28gCO含有相同的氧原子数。
。其中含有1mol氧原子,则它与28gCO含有相同的氧原子数。
③37%的盐酸密度为(1.19g·cm-3)的浓度为![]() =12mol/L。将4mL此浓盐酸加水稀释到200ml,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12mol/L÷50=0.24mol/L。
=12mol/L。将4mL此浓盐酸加水稀释到200ml,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12mol/L÷50=0.24mol/L。
④在标准状况下22.4L由氮气和氧气组成给的混合气体的物质的量是1mol,其质量为30g,因此混合气体的平均相对分子质量是30,则根据十字交叉法可知氮气和氧气的物质的量之比是![]() ,说明氧气是0.5mol,则其中氧气的质量为16g。
,说明氧气是0.5mol,则其中氧气的质量为16g。
⑤同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,二者的物质的量相等,A的物质的量是1g÷2g/mol=0.5mol,则A的相对分子质量为16÷0.5=32。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅和硅的化合物性质的叙述,正确的是( )
A.二氧化硅是酸性氧化物,不跟任何酸起反应
B.二氧化硅的化学键是共价键,可溶于水制得硅酸
C.根据CO2通入水玻璃中可制得硅酸,可知碳酸的酸性比硅酸强
D.硅在常温下能跟氢气起反应生成SiH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是
分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 熟石灰 | H3PO4 | BaCO3 | BaO2 | SO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | 烧碱 | HNO3 | Cu2(OH)2CO3 | Na2O2 | Mn2O7 |
D | KOH | CH3COOH | KHCO3 | CaO[ | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况),向反应后的溶液中加入1mol·L—1NaOH溶液使金属离子恰好沉淀,过滤。下列有关说法错误的是
A.混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1
B.需加入NaOH溶液1000mL
C.稀硝酸的物质的量浓度是2mol·L—1
D.最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的是 ( )
A.(3m+n)mol
B.(3m+n+2p)mol
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两元素原子的L层电子数都是其他层电子总数的2倍。下列推断正确的是( )
A. 甲与乙位于同一周期 B. 甲与乙位于同一主族
C. 甲与乙都位于元素周期表的p区 D. 甲与乙的原子序数之和为偶数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com