
下列有关物质或应用正确的是
A.单质硅可用于制造光纤和太阳能电池
B.在常温下可用铝制容器贮藏运输浓硫酸
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性小于铁,可在海轮外壳上装若干铜块以减缓其腐蚀
科目:高中化学 来源: 题型:阅读理解
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 水浴 |
| 水浴 |
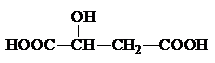 ,该分子中官能团的名称为
,该分子中官能团的名称为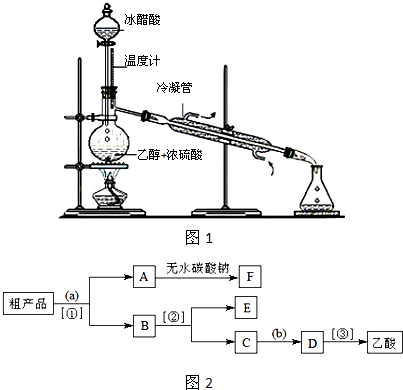
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是 ;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出
葡萄糖发生银镜反应的化学方程式: 。
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为,该分子中官能团的名称为 ,可以和醇类物质发生 反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为 。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是 ;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号) ;
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
试剂a是 ,分离方法①是 ;分离方法②是 ,试剂b是 ;
④写出C → D 反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010年北京市八一中学高一第二学期期末考试化学试卷 题型:填空题
有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是 ;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出
葡萄糖发生银镜反应的化学方程式: 。
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为 ,该分子中官能团的名称为 ,可以和醇类物质发生 反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为 。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是 ;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号) ;
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
试剂a是 ,分离方法①是 ;分离方法②是 ,试剂b是 ;
④写出C → D 反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com