
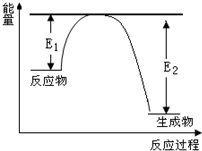
 2013年12月2日我国成功发射的“嫦娥三号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2
2013年12月2日我国成功发射的“嫦娥三号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2| 高温 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| 高温 |
| x |
| 2-x |
| 高温 |
| x |
| 2-x |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
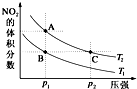 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )| A、B、C两点N2O4的转化率:B=C |
| B、A、C两点气体的颜色:A浅,C深 |
| C、A、C两点N2O4的转化率:A>C |
| D、状态B和状态A,平衡常数:A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | E | R | F | |||||
| 三 | A | C | D | H | I | G | ||
| 四 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空: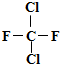 ,下列叙述正确的是:
,下列叙述正确的是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com