
【题目】类比法是一种常用的化学思维,下列各项中类比结论正确的是
选项 | 已知 | 类比结论 |
A | 强碱弱酸盐 |
|
B |
|
|
C | 用惰性电极电解熔融的 | 用惰性电极电解熔融的 |
D |
|
|
A.AB.BC.CD.D
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)![]() 2SO2(g)+ O2(g)。下列有关说法正确的是
2SO2(g)+ O2(g)。下列有关说法正确的是

A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲
B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲
C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲
D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.明矾和Ba(OH)2溶液反应至硫酸根沉淀完全的离子方程式:Al3++![]() +Ba2++3OH-=Al(OH)3↓+BaSO4↓
+Ba2++3OH-=Al(OH)3↓+BaSO4↓
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液通过量CO2制Al(OH)3:CO2+![]() +2H2O=Al(OH)3↓+
+2H2O=Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是(混合后溶液体积变化忽略不计)
A. 将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B. 将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C. 将pH=2的H2X溶液稀释至原来的1 000倍,得到混合溶液的pH=5
D. 将pH=1的盐酸和0.1 mol·L-1 的Ba(OH)2溶液等体积混合,混合液的pH=12.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.114号元素在周期表中第七周期第VIA族,属于金属元素
B.晶体硅熔点高硬度大,可用于制作光导纤维
C.为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸
D.光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有足量A的容积固定的密闭容器中加入B,发生反应:A(s)+2B(g) 4C(g)+D(g) ΔH<0。一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示。其他条件不变,下列措施能使θ值增大的是( )

A. 降低温度B. 增大压强C. 加入催化剂D. 再加入少量A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图。根据要求填空:
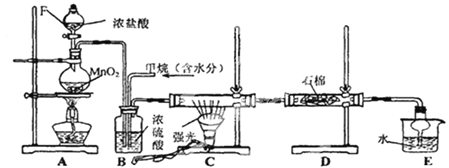
(1)写出CH4与Cl2生成一氯代物的化学反应方程式_________________________________。
(2)B装置有三种功能:①控制气体流速;②将气体混合均匀;③_______________________________。
(3)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是_________________________。
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为_______________。
(5)该装置还有缺陷,原因是没有进行尾气处理,尾气的主要成分是_______________。(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据短周期元素的信息回答问题。
元素信息 | |
A | 第3周期第ⅥA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne电子数相同 |
(1)写出A、B的元素符号____________、_________,C、D的元素的名称__________、_____________。
(2)写出B、C单质在加热时反应的方程式____________________________________
(3)从原子结构角度分析A与B的______________相同,C与D的_______________相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
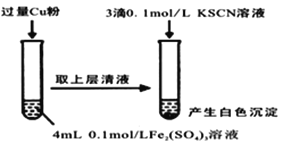
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com