
| A. | 燃烧法 | B. | 质谱法 | C. | 红外光谱法 | D. | 核磁共振氢谱法 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4 g | |
| D. | 中和滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视锥形瓶中溶液颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴乙烷与NaOH溶液共热几分钟后,冷却、滴加AgNO3溶液,验证产物Br- | |
| B. | 在溴化铁的催化下苯与浓溴水反应制取溴苯 | |
| C. | 石油在常压下分馏可得到石蜡 | |
| D. | 乙烯通入到酸性KMnO4溶液使之褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
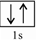
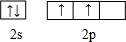
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃10mL 4mol/L的X溶液 | ||
| C. | 20℃30mL 2mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 石灰石和盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com