
电解下列物质的水溶液,在阴极上有金属析出的是( )
A.HCl B.CuCl2
C.NaOH D.CaCl2
科目:高中化学 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol•L﹣1的盐酸的体积至少为( )
|
| A. | 0.05 L | B. | 0.1 L | C. | 0.2 L | D. | 1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
某种甜味剂A的结构简式为
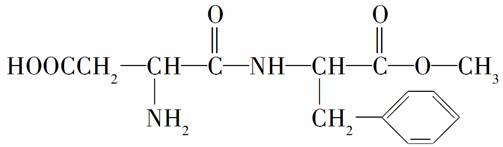
(1)写出A在无机酸催化下完全水解所得含碳原子数最多的有机物(设为B)分子的名称________。
(2)写出B形成的高分子化合物的结构简式________,反应类型________。
(3)1 mol A发生加成反应需要H2的最大用量及与足量NaOH溶液反应消耗NaOH的物质的量分别为________mol和________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.NaOH B.H2SO4
C.AgNO3 D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。

按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________(用a、b表示);
(2)写出装置中镀锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为__________;(不许用“NA”表示);
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向向表述正确的是__________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
A.NaOH B.Zn
C.Fe D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
镀锌铁在发生析氢腐蚀时,若有0.2 mol电子发生转移,下列说法正确的是( )
①有5.6 g金属被腐蚀 ②有6.5 g金属被腐蚀 ③在标准状况下有2.24 L气体放出 ④在标准状况下有1.12 L气体放出
A.①② B.②③
C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将氧化还原反应2H2+O2===2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通入的气体应是________,正极通入的气体是________,电极反应为:正极__________________,负极______________________。
(2)若把KOH溶液改为稀硫酸做电解质溶液,则电极反应为:正极________,负极________________。
(3)若把H2改为CH3OH,KOH溶液做电解质溶液,则电极反应为:正极_____________________________________________,
负极__________。电池反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:

50mL 0.05mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)烧杯间填满碎泡沫塑料的作用是______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”或“偏小”或“无影响”)。
(4)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由:_____________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;用50mL 0.50mol·L-1 NaOH溶液进行上述实验,测得的中和热数值会________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)化学反应中均伴随着能量的变化。如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应为________(填“吸热反应”或“放热反应”)。

(2)当前,国际石油价格持续上涨,每桶原油期货价格达到了130美元左右,为了减少石油价格带来的影响,很多汽车开发商开始投资研制以各种电池为动力的汽车。
①在银锌原电池中,以硫酸铜为电解质溶液,锌为________极,银电极上的电极反应式是________________;当烧杯中的溶液质量变化1 g时,电路中有________mol电子通过。
②氢氧燃料电池是目前最成熟的燃料电池。如图为一种氢氧燃料电池结构示意图,电解质溶液为氢氧化钾溶液,电极材料为石墨,氢气和氧气(或空气)源源不断地通到电极上。该燃料电池负极的电极反应式为_____________,电池反应为_________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com