
(本题共13分)药物M主要用于防治骨质疏松症和乳腺癌,其结构式为
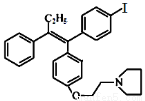 (不考虑立体结构)。
(不考虑立体结构)。
M的新旧二条合成路线如下:
旧路线

新路线
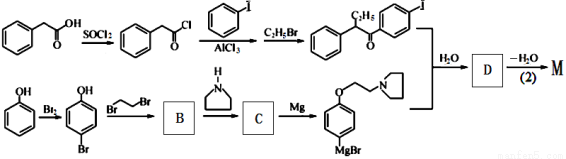
已知:(1)半缩醛可水【解析】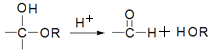
(2)卤代烃(RX)与镁于室温下在干燥乙醚中反应,生成格氏试剂(RMgX):RX+Mg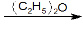 RMgX
RMgX
格氏试剂很活泼,能与许多物质发生反应。如:

完成下列填空:
(1)写出反应类型。 (1) (2)
(2)写出结构简式。 A D
(3)旧法中的原料 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有 种。
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有 种。
任写其中一种的结构简式 。
(4)写出B→C反应的化学方程式 。
(5)设计一条以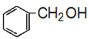 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇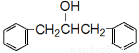 的合成路线 (不超过5步反应)。
的合成路线 (不超过5步反应)。
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:选择题
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g) = CH3COOH(l) 的反应热ΔH为
A.+488.3 kJ/mol B.-488.3 kJ/mol
C.-244.15 kJ/mol D.+244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:计算题
(2分)若25℃时,CH3 COOH的电离平衡常数Ka = 1.8×10-5,则该温度下0.18mol/L的CH3 COONa溶液的pH= (CH3 COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3 COONa溶液的浓度)
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)
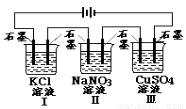
A.13、7、1 B.12、7、2
C.1、7、13 D.7、13、1
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是
A.未用标准液润洗滴定管
B.盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失
C.锥形瓶用蒸馏水洗,未用待测液润洗
D.振荡时锥形瓶中液滴飞溅出来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:填空题
肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式 ,肼的晶体类型 。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式 。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
写出该反应的热化学方程式 。
(4)室温下,N2H5Cl的水溶液显 (填酸、碱、中)性。
其原因是。
已知:H2O 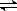 H + + OH- Kw = 1×10-14
H + + OH- Kw = 1×10-14
N2H4 + H2O 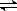 [N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + H2O 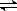 [N2H6]2++ OH- K2 = 8.4×10-15
[N2H6]2++ OH- K2 = 8.4×10-15
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为 。
与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
下列实验现象描述正确的是
A.电解氯化铜溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
D.向含有苯酚的苯溶液中滴入少量浓溴水,产生了白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:实验题
(12分)某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件。某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10 mol/L硝酸反应时有NO2气体生成,可能还有NO生成。
查阅资料:常温下,NO2与N2O4混合存在,在低于0 ℃时几乎只有无色的N2O4液体或晶体存在。
设计如下装置进行实验。按下图连接装置并检验气密性后,称取5 g 合金放于圆底烧瓶中,并滴加10 mol/L硝酸。
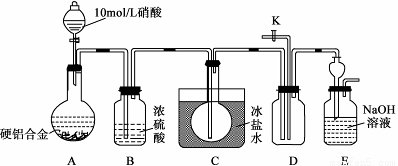
①合金中Cu与稀硝酸反应的离子方程式是 。
②C装置的目的是 。
③能证明有NO2生成的实验现象是 ,能证明有NO生成的实验操作与现象是 。
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10 mol/L硝酸反应时没有NO生成。乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是 。
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
Al3+ | 3.4 | 4.7 |
Cu2+ | 4.1 | 6.9 |
Mg2+ | 9.4 | 12.4 |
pH > 7.8时,Al(OH)3开始溶解,pH > 10.8时沉淀完全溶解。
设计如下方案并进行实验:
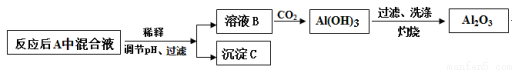
①调节pH时,应控制pH的范围是 。
②选用NaOH溶液调节pH,得到溶液B的离子方程式是 。
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:填空题
铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝离子的结构示意图为 。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)氢氧化铝是医用的胃酸中和剂的一种。用离子方程式表示其作用机理是 。
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对。 |
B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对。 |
C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对。 |
D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对。 |
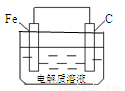
(6)钢铁的析氢腐蚀简单示意图如下图所示,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com