
【题目】下列说法正确的是( )
A. 若反应X + Y = M是放热反应,该反应一定不用加热。
B. 需要加热方能发生的反应一定是吸热反应。
C. 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
D. CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。

(1)若加入的试剂①为NaOH,加入试剂①的目的___。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、___。
(3)加入的试剂③为___(填化学式),发生的离子反应方程式为___。
(4)固体E的成分为Fe和Cu,写出E和加入试剂④所发生的离子反应方程式为__。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、冷却结晶、__、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且a点溶液的导电性比b点弱
B.图2表示常温时用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示压强对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节PH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的A、B、C、D、E五种元素,其中只有E是第四周期元素,A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)E的+2价离子基态核外电子排布式为_______。
(2)A、B、C、D原子中,电负性最大的是_______(元素符号)
(3)1 mol B2A4分子中σ键的数目为______。B4A6为链状结构,其分子中B原子轨道的杂化类型只有一种,则杂化类型为_______。
(4)C的简单氢化物在D 的简单氢化物中具有很大的溶解度,其主要原因是______。
(5)E和C形成的一种化合物的晶胞结构如图所示,该化合物的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明一氧化碳具有还原性,有人设计了下列实验:


(1)装置A中生成的主要产物是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验,装置B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。
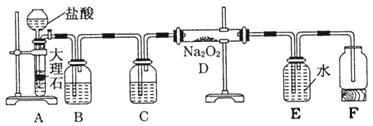
(1)C中盛有________,目的是________。
(2)写出装置D中发生反应的化学方程式___________。
(3)指出装置E的错误___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质
①NaCO310H2O 晶体 ②铜 ③浓硫酸 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的 氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质属于强电解质的有___________________(填编号)。
(2)上述物质中有两种在水溶液中可发生离子反应:H+ +OH﹣=H2O,写出对应的化学方程式___________________________________。
(3)⑩可以作净水剂,请用离子方程式解释其原因_____________。17.1g的⑩溶于水配成 250mL 溶液,![]() 的物质的量浓度为______________。
的物质的量浓度为______________。
(4)将⑥的溶液滴加到⑤的溶液中至恰好沉淀,发生反应的离子方程式_____________________。
(5)②与⑨发生反应的化学方程式为 ![]() 。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com