
【题目】下列物质不可能是乙烯加成产物的是( B )
A. CH3CH3 B. CH3CHCl2 C. CH3CH2OH D. CH3CH2Br
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为(用化学符号表示),化学式为;
(2)C溶液可溶解铜片,例举该反应的一个实际应用;
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL﹣1),该气体分子的电子式为 , 写出该反应的离子方程式;
(4)写出F→G反应的化学方程式,设计实验方案探究溶液G中的主要微粒(不考虑H2O,H+ , K+ , I﹣) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,用元素符号或化学用语回答下列问题.
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ⑨ |
(1)10种元素中,化学性质最不活泼的是 , 除⑩外原子半径最大的是
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为
(3)⑥和高价态的⑤形成的化合物的电子式是 , ①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为;用电子式表示元素③和⑨形成化合物的过程
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是 , 原因是
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式
(7)下列叙述中,肯定a金属比b金属活泼性强的是(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是 ( C )
A. 点燃 B. 催化加氢
C. 慢慢地通入溴水中 D. 慢慢地通入酸性高锰酸钾溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g).
Si3N4(s)+6CO(g).
(1)该反应的平衡常数表达式为K=_______;
(2)若知上述反应为放热反应,则其反应热ΔH_____0(填“>”“<”或“=”);升高温度,其平衡常数值___(填“增大”“减小”或“不变”));若已知CO生成速率为v(CO)=15mol·L-1·min-1,则N2消耗速率为v(N2)=______;
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t2时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
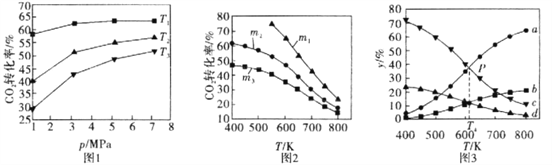
(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在高温条件下可发生分解:2CH4→C2H2+3H2 , 现使甲烷分解得到的混合物的气体对氦的相对密度为2.5,则甲烷的分解率是( )
A.50%
B.60%
C.70%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有广泛应用.
(1)磷酸二氢钙,广泛用于动物的饲料添加剂.目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点pH为3.2,既得磷酸二氢钙.请写出该反应的化学方程式;若有1×103kg石灰石最多能生产kg磷酸二氢钙.
(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣可用来 .
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 ![]() )之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
)之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
(4)次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2﹣ , 在酸性条件下发生下述反应:请配平该反应离子方程式Ni2++H2PO2﹣+═Ni++H2PO3﹣+ .
(5)H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):①写出阳极的电极反应式 .
②分析产品室可得到H3PO2的原 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
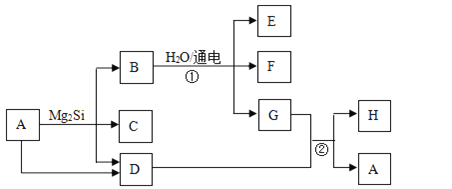
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com