
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O72—+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
| A.10 | B.12 | C.14 | D.16 |
科目:高中化学 来源: 题型:单选题
科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米捧。相关反应的化学方程式为:8Na+CCl4十SiCl4=SiC十8NaCl。下列说法不正确的是( )
| A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 |
| B.上述反应中SiC既是氧化产物又是还原产物 |
| C.SiCl4是由极性键构成的非极性分子 |
| D.CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
液态金属汞常温下即可蒸发,其蒸气有剧毒, 实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:
4CuI+Hg= Cu2HgI4+2Cu(I的化合价反应前后均为-1价的)。下列有关说法不正确的是( )
| A.上述反应的产物Cu2HgI4中,Hg的化合价为+2 |
| B.上述反应中氧化剂是CuI |
| C.上述反应中Cu元素仅有一半被还原 |
| D.上述反应中生成64gCu时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 | B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 | D.每消耗10g CaCO3生成2.24L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关氧化还原反应的叙述正确的是
| A.在一定条件下能发生反应:3O2=2O3,该反应不属于氧化还原反应 |
| B.氧化反应一定先于还原反应发生 |
| C.氧化性强的物质与还原性强的物质接触一定能发生反应 |
| D.氧化剂本身一定只发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气( )
| A.2 mol | B.2.5 mol | C.3 mol | D.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )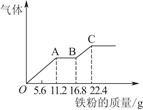
| A.原混合酸中NO物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
| A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.四种铈的核素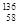 Ce、 Ce、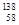 Ce、 Ce、 Ce、 Ce、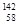 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com