
【题目】某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.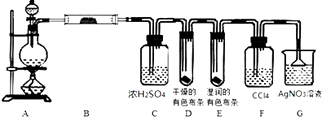
(1)用MnO2和浓盐酸混合共热制得氯气的化学方程式是;
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2 , 制得的Cl2体积在标准状况下总是小于1.12L的原因是;
(3)①装置B的作用是;②装置D和E出现的不同现象说明的问题是;
③装置F的作用是;
④装置G中发生反应的化学方程式为 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应
(3)检验制备的氯气中水蒸气;氯气没有漂白性,氯水有漂白性;除去氯气,防止对HCl气体检验的干扰;HCl+AgNO3═AgCl↓+HNO3
【解析】解:(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应,有0.2mol HCl的浓盐酸与足量的MnO2反应制得的Cl2体积在标准状况下总是小于1.12L,所以答案是:加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应;(3)①装置B中盛放无水硫酸铜,白色固体变为蓝色,说明制备氯气中含有水蒸气,所以答案是:检验制备的氯气中水蒸气;②干燥的氯气没有漂白性,D中有色布条不褪色,氯气与水反应生成的HClO具有漂白性,E中湿润的有色布条褪色,说明氯气没有漂白性,氯水有漂白性所以答案是:氯气没有漂白性,氯水有漂白性;③氯气通入硝酸银溶液也会生成AgCl沉淀,装置F的作用:除去氯气,防止对HCl气体检验的干扰,所以答案是:除去氯气,防止对HCl气体检验的干扰;④G中HCl与硝酸银溶液反应生成AgCl沉淀,反应离子方程式为:HCl+AgNO3═AgCl↓+HNO3 , 所以答案是:HCl+AgNO3═AgCl↓+HNO3 .
MnCl2+Cl2↑+2H2O;(2)加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应,有0.2mol HCl的浓盐酸与足量的MnO2反应制得的Cl2体积在标准状况下总是小于1.12L,所以答案是:加热时浓盐酸因挥发而损失,随着反应的进行消耗HCl,盐酸浓度变稀以后将不再反应;(3)①装置B中盛放无水硫酸铜,白色固体变为蓝色,说明制备氯气中含有水蒸气,所以答案是:检验制备的氯气中水蒸气;②干燥的氯气没有漂白性,D中有色布条不褪色,氯气与水反应生成的HClO具有漂白性,E中湿润的有色布条褪色,说明氯气没有漂白性,氯水有漂白性所以答案是:氯气没有漂白性,氯水有漂白性;③氯气通入硝酸银溶液也会生成AgCl沉淀,装置F的作用:除去氯气,防止对HCl气体检验的干扰,所以答案是:除去氯气,防止对HCl气体检验的干扰;④G中HCl与硝酸银溶液反应生成AgCl沉淀,反应离子方程式为:HCl+AgNO3═AgCl↓+HNO3 , 所以答案是:HCl+AgNO3═AgCl↓+HNO3 .
【考点精析】掌握氯气的实验室制法是解答本题的根本,需要知道实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
Ⅰ.以氨为原料,合成尿素的反应原理为:
2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g)△H=a kJ/mol.
为研究平衡时CO2的转化率与反应物投料比( ![]() )及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).
)及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).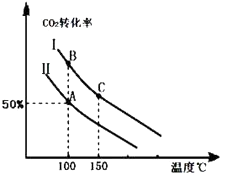
(1)a0 (填“>”或“<”),判断依据是 .
(2)①投料比:Ⅱ(填“>”或“<”).
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为 .
③A点平衡常数与B点平衡常数间的关系:KAKB(填“>”或“<”或“=”).B点正反应速率与C点正反应速率间的关系为:v(B)v(C)(填“>”或“<”或“=”).
(3)若按曲线Ⅰ的投料比投料,在上述实验中压缩容器体积至5L,在图中画出反应达平衡时的二氧化碳的转化率与温度之间的关系曲线.
(4)为提高CO2转化率可以采取的措施是 .
a.使用催化剂 b.及时从体系中分离出部分CO(NH2)2c.将体系中的水蒸气液化分离
氨气可用于工业上生产硝酸,其尾气中的NO2可用氨水吸收生成硝酸铵,25℃时,将10molNH4NO3溶于水,溶液显酸性,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“逆向”或“不”) 移动,此中性溶液中NH3H2O的物质的量为mol.(25℃时,NH3H2O的电离平衡常数Kb=2×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘中各放入一个质量相等的烧杯,两烧杯中各盛有100mL1mol/L 硫酸溶液,向两烧杯中分别加入各组中的两种物质,反应后天平保持平衡的是( )
A.0.1mol Zn,0.1mol Fe
B.1mol Fe,1mol Zn
C.1g Zn,1g Fe
D.10g Zn,10g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84gcm﹣3)配制1molL﹣1的稀硫酸100mL.配制过程中可能用到下列仪器:①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.按使用先后顺序排列正确的是( )
A.④③⑦⑤⑥
B.②⑤⑦④⑥
C.④③⑤⑥⑦
D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学研究证明,用放射性 ![]() I治疗肿瘤可收到一定疗效.下列有关
I治疗肿瘤可收到一定疗效.下列有关 ![]() I叙述正确的是( )
I叙述正确的是( )
A.![]() I是碘的一种同素异形体
I是碘的一种同素异形体
B.![]() I是一种新发现的元素
I是一种新发现的元素
C.![]() I位于元素周期表中第4周期Ⅳ族
I位于元素周期表中第4周期Ⅳ族
D.![]() I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 mol
D.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com