
| A、实验室制氢气时用粗锌比用纯锌放出氢气快 |
| B、镀锌铁(在铁上镀一层锌)比镀锡铁耐腐蚀 |
| C、铝制门窗不用涂刷油漆 |
| D、轮船水线以下的船壳上装一定数量的锌块 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、投入到足量水中 |
| B、投入到足量盐酸中 |
| C、投入到足量CuSO4溶液中 |
| D、用刺有小孔的铝箔包好放入足量水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极发生的反应为:Fe-3e-=Fe3+ |
| B、正极发生的反应为:2H2O+O2+4e-=4OH? |
| C、原电池是将电能转变为化学能的装置 |
| D、钢铁在水下部分比在空气与水交界处更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不是电解质的物质就是非电解质 |
| B、将纯水加热至较高温度,Kw变大 |
| C、BaSO4不溶于水,其水溶液的导电能力很弱,所以为弱电解质 |
| D、电解质在任何状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、垃圾处理常用的方法是卫生填埋、堆肥和焚烧 |
| B、将垃圾分类并回收是处理的发展方向 |
| C、填埋垃圾不需要治理,只需深埋即可 |
| D、垃圾是污染物,不会产生二次污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
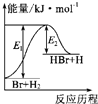
| A、该反应的△H=+(E1-E2)kJ?mol-1 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com