
某稀硫酸和硝酸的混合溶液200 mL,
分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。
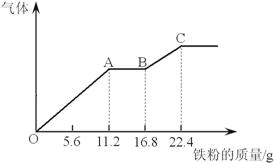
(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
【知识点】物质之间的反应和图像的分析
【答案解析】(1)FeSO4
(2)NO H2 Fe +2Fe 3+=3Fe2+
(3)0.4 4
解析:当在溶液中加入铁粉时,铁首先应该与硝酸反应生成Fe3+,即OA段产生的是NO;当硝酸完全反应时,铁与Fe 3+反应生成Fe 2+,即AB段发生的反应为Fe +2Fe 3+=3Fe2+;当Fe 3+完全反应后再加入铁粉,铁与溶液中的H+反应,即BC段产生的气体是H2;根据分析得到第二份溶液中最终溶质为FeSO4。
根据图示可以看出溶液中的H+足够,所以在OA段NO3—完全反应,
Fe+4H++NO3—= Fe3++NO+H2O ①
n(Fe)=11.2g/56g/mol=0.2mol= n(NO3—)=n(HNO3),故原混合酸中HNO3的物质的量为0.4mol;
BC段发生的是Fe+2H+= Fe2+ +H2 ②
n(H+)= 2n(Fe)=2×5.6g/56g/mol=0.2mol,
在①中由硫酸提供的n(H+)=3 n(NO3—)= 0.6mol,故第二份溶液中n(H+)总=0.8mol,n(H2SO4)= 0.4mol,则原溶液中n(H2SO4)= 0.8mol,H2SO4的物质的量浓度应为0.8mol /200 mL =4mol/L。
【思路点拨】①此溶液分成了两等分,②硝酸根在酸性的条件下提供氧化性是本题考查的重点,是易错题,综合性强。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
由海水制取无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.①③⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种元素均位于第三周期,其原子序数逐渐增大,甲的最高价氧化物对应的水化物是强碱,乙是地壳中含量最多的金属元素,丙是本周期中原子半径最小的元素。下列说法不正确的是
A.甲是第IA元素,丙是第VIIA元素
B.甲、丙形成的化合物是离子化合物
C.乙的最高价氧化物是两性氧化物
D.丙是元素周期表中非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数为NA,下列说法正确的是 ( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子
C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O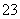 +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
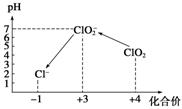
请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X可能含有Ba2+、Al3+、NH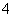 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO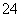 、Cl-、NO
、Cl-、NO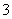 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:
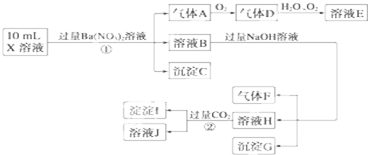
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是___▲___,不能确定是否含有的离子(M)是___▲___,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是__▲____.
(2)写出反应②的离子方程式:___▲___.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式___▲___.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有___▲___.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH | 少量Ba(OH)2溶液 | 2NH |
| B | Mg2+、HCO | 过量NaOH溶液 | Mg2++2HCO |
| C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
| D | Fe2+、NO | NaHSO4溶液 | HSO |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性强弱:I— >Fe2+。往100 mL碘化亚铁
溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1 B.1.5mol·L-1 C.1.2mol·L-1 D.1.0mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸(主要成分为盐酸)。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
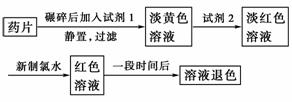
(1)试剂1是________,试剂2是________,加入新制氯水所发生的离子反应方程式是______________________。
(2)该同学猜想红色溶液退色的原因是溶液中的Fe3+被还原为Fe2+,你认为该同学的猜想合理吗?________,理由是________________________;请设计一个简单的实验加以验证________________________________________________________________________。
(3)该药品须密封保存,若表面出现颜色变化,说明部分Fe2+已变成Fe3+。药品中经常放入维生素C,可以延长保质期。请你解释原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com