
【题目】常温下联氨(N2H4)的水溶液中存在有:①N2H4+ H2O![]() N2H5++OH- K1②N2H5+ +H2O
N2H5++OH- K1②N2H5+ +H2O![]() N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
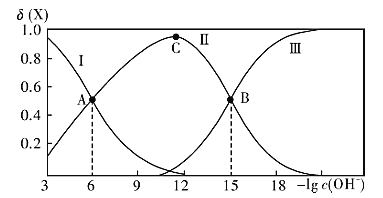
A.图中Ⅲ对应的微粒为N2H62+
B.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+ )
C.将10mL0.1mol/L的联氨溶液与5mL0.1mol/L.的盐酸溶液混合后,所得溶液pH等于8
D.常温下羟胺(NH2OH)的Kb=10-10,将少量联氨水溶液加入到足量NH3OHCl溶液中,发生的反应为N2H4+NH3OH+=N2H5+ +NH2OH
【答案】C
【解析】
横坐标为c(OH-)的负对数值,从左到右c(OH-)越来越小,越能促进N2H4的电离,纵坐标为微粒的物质的量分数,已知联氨的两步电离分别为:N2H4+H2ON2H5++OH-,N2H5++H2ON2H62++OH-,故曲线Ⅰ为N2H4、Ⅱ为N2H5+、Ⅲ为N2H62+。
A. 图中Ⅲ对应c(OH-)最小,N2H4的电离平衡正向移动程度大,图中Ⅲ对应的微粒为N2H62+,A正确;
B. N2H5Cl溶液中存在电荷守恒,即c(OH-)+c(Cl-)= c(H+)+c(N2H5+ )+2c(N2H62+ ),从图象可知,C点c(H+)> c(OH-),故c(Cl-)>c(N2H5+ )+2c(N2H62+ ),B正确;
C. 10mL0.1mol/L的联氨溶液与5mL0.1mol/L的盐酸溶液混合后,联氨过量,发生反应方程式为:N2H4+HCl==N2H5Cl,N2H5+水解:N2H5++H2O![]() N2H4·H2O+H+,所得溶液显酸性,pH<7,C错误;
N2H4·H2O+H+,所得溶液显酸性,pH<7,C错误;
D. 常温下,NH3OHCl溶液中,NH3OH+水解:NH3OH++ H2O![]() NH2OH·H2O+ H+,显酸性,联氨电离:N2H4+ H2O
NH2OH·H2O+ H+,显酸性,联氨电离:N2H4+ H2O![]() N2H5++OH-,显碱性,所以NH3OHCl溶液中加入少量联氨水溶液,发生反应为:N2H4+NH3OH+=N2H5+ +NH2OH,D正确;
N2H5++OH-,显碱性,所以NH3OHCl溶液中加入少量联氨水溶液,发生反应为:N2H4+NH3OH+=N2H5+ +NH2OH,D正确;
答案为C。


科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
B. 25℃时,0.1mol L-1的HA溶液中![]() = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,BaSO4在水中有沉淀和溶解的平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下:

已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。
(1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。
(2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。
(4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。
(5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。
a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸
(6)制取过程中,若pH调节不合理易生成Mn2+。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含0.05mol·L-1Mn2+废水中通入一定量H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__________。[已知:H2S的Ka1=1.3×10-7 Ka2=5.0×10-15;Ksp(MnS)=2.5×10-14]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -Q1
2H2(g) + O2(g) = 2H2O(g) ΔH = -Q2; 2H2(g) + O2(g) = 2H2O(l) ΔH = -Q3
常温下,取甲烷和氢气体积比为4:1的混合气体11.2L(已折合成标准状况),完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1 + 0.05Q2B.0.4Q1 + 0.05Q3C.0.4Q1 + 0.1Q2D.0.4Q1 + 0.1Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是

A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
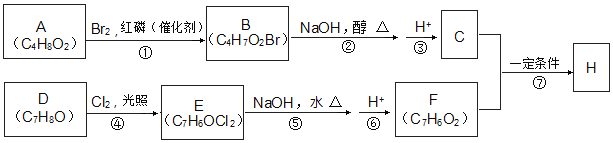
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com