
| 浓硫酸 |
| 50℃~60℃ |
| 浓硫酸 |
| 50℃~60℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
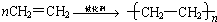 ,故答案为:
,故答案为: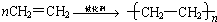 .
.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| 元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ? |
| 原子半径(10-10m) | - | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
| 最高或最 低化合价 |
0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
| -2 | -3 | -4 | -1 | -3 |
| A、上表中11种元素中形成的非金属单质都有非极性共价键 |
| B、②⑨处于同一周期,④⑧处于同一主族 |
| C、上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强 |
D、⑥原子结构示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤⑥ | B、②④⑥ |
| C、②⑥ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
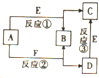 物质A-F有如图所示的转化关系,已知B为非金属气态单质.
物质A-F有如图所示的转化关系,已知B为非金属气态单质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
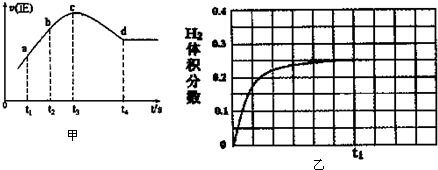
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| B、100 mL 0.1 mol?L-1 Na2CO3溶液中,离子总数是0.03NA |
| C、1 mol NH4+中含有质子数为10 NA |
| D、常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com