
 ,
, .
.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| A、用托盘天平称量17.55g氯化钠晶体 |
| B、碳酸钠溶液保存在带玻璃塞的试剂瓶 |
| C、用干燥的pH试纸测定新制氯水的pH |
| D、使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大 |
| E、向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体 |
| F、除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、④⑤ |
| C、④⑤⑦ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
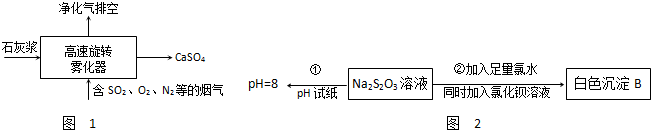
查看答案和解析>>
科目:高中化学 来源: 题型:
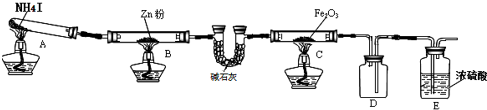
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
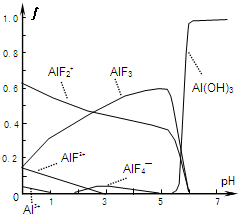 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com