
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表的相对位置如表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023
B.一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023
C.含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L
D.100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl— 的个数为0.6×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
 |
请回答下列问题:
(1)表中属于d区元素的是 (填编号)。
(2)写出基态⑨原子的电子排布式 。
(3)元素⑦形成的RO32- 含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(4)元素①的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,①原子采用sp2杂化
(5)元素⑦(用X表示)的氢化物和元素③(用Y表示)的一种氢化物的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
H2X和H2Y2相对分子质量基本相同,造成上述物理性质差异的主要原因
、 。
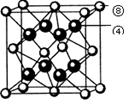 (6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
(6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于石油的说法中,不正确的是
A.石油主要含烃类物质,这些烃类物质随着烃分子含有的碳原子数的增加沸点升高
B.常压分馏得到的汽油是混合物,没有固定的沸点,但石油气为纯净的丙烷
C.石油分馏不是化学变化,但裂化是化学变化
D.裂化的目的是得到轻质油,裂解的目的是得到乙烯、丙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应4 NH3(g)+5O2(g)  4NO(g)+6 H2O(g)下列叙述正确的是
4NO(g)+6 H2O(g)下列叙述正确的是
A.达到化学平衡时,4v正(O2)= 5v逆(NO )
B.若单位时间内生成x mol NO,同时消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大
D.在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是

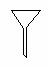


A.蒸馏、蒸发、分液、过滤 B.蒸馏、过滤、分液、蒸发
C.分液、过滤、蒸馏、蒸发 D.过滤、蒸发、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,溴主要以Br-形式存在于海水中,海水呈弱碱性。回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,该过程的离子方程式为 ,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)需要使用溴时,用硫酸酸化得到的Br-和BrO3-的混合物,而不用盐酸酸化混合物的原因可能是 。
(3)Cl2通入冷的石灰乳,用于制漂白粉,反应的化学方程式为
。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com