
下列各组化合物中,不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O2和生成的H2O的质量不变的是()
A. C2H2 C6H6 B. C2H6 C3H6 C. C2H4 C3H4 D. C2H4 C2H5OH
考点: 有关混合物反应的计算.
专题: 计算题.
分析 : 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成H2O的质量也一定,则说明混合物各组分分子中含氢量相等.当各烃的最简式相同时,不论二者以什么比例混合,只要总质量一定,则完全燃烧时,消耗O2的质量和生成水的质量不变,D选项结合H元素质量分数判断.
: 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成H2O的质量也一定,则说明混合物各组分分子中含氢量相等.当各烃的最简式相同时,不论二者以什么比例混合,只要总质量一定,则完全燃烧时,消耗O2的质量和生成水的质量不变,D选项结合H元素质量分数判断.
解答: 解:无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成H2O的质量也一定,则说明混合物各组分分子中含氢量相等.当各烃的最简式相同时,不论二者以什么比例混合,只要总质量一定,则完全燃烧时,消耗O2的质量和生成水的质量不变,
A、C2H2和C6H6最简式相同,故A符合;
B、C2H6和C6H6最简式不同,故B错误;
C、C2H4和C3H4最简式不同,故C错误;
D、乙醇分子式为C2H6O,氢元素的质量分数为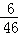 ,乙烯中氢元素的质量分数
,乙烯中氢元素的质量分数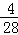 ,氢元素的含量不同,故D错误;
,氢元素的含量不同,故D错误;
故选A.
点评: 本题考查混合物的计算,难度中等,注意把握题中信息,得出混合物中各烃满足最简式相同、氢元素的质量分数相等是解题的关键.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
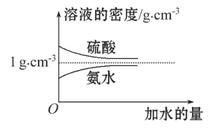
| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度 /g·cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与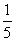 c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度
c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度 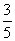 c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去KCl中的Ca2+,Mg2+,SO42﹣及泥沙,得到纯净的KCl,可将固体溶于水,然后在下列操作中选取必要的步骤和最佳的操作顺序( )
①过滤 ②加过量KOH溶液 ③加适量盐酸 ④加过量K2CO3溶液 ⑤加过量BaCl2溶液.
|
| A. | ②①⑤①④①③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
有下列七种物质:①甲烷、②苯、③聚乙烯、④聚乙炔、⑤2﹣丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液退色,又能使溴水因反应而退色的是()
A. ②③④⑤ B. ③④⑤⑦ C. ④⑤⑥ D. ④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活和社会密切相关.下列说法不正确的是()
A. 漂白粉长期暴露在空气中会变质失效
B. 雾霾天车灯照射的光亮通路属于丁达尔现象
C. 硬铝属于合金材料,瓷器属于硅酸盐制品
D. 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬
查看答案和解析>>
科目:高中化学 来源: 题型:
碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
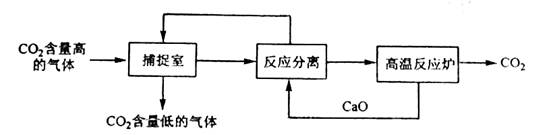
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用____________________。
a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器:____________________ (填编号)。

(3)如下图,在一个充满氧气的集气瓶中加入少量品红稀溶液,点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是____________________。

(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为____________________。反应过程中,溶液的pH____________________ (填“变大”“变小”或“不变”)。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是____________________。
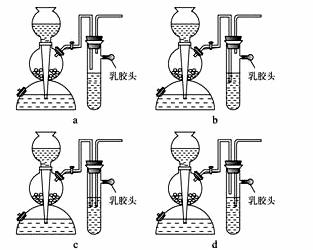
(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com