
【题目】下列物质中,硫元素化合价最高的是
A.Na2SO4B.H2SC.SO2D.S8
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
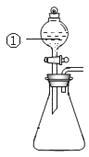
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
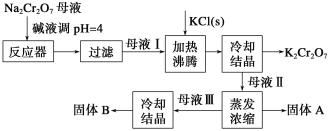
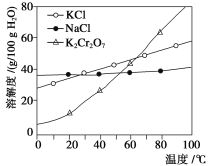
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构式为 ,它在一定条件下能发生的反应有( )
,它在一定条件下能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③⑤⑥ C. ①③④⑤ D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,CaF2,MgCl2请你回答下列问题:
①I2的电子式为_________________;CaF2的电子式为_________________;
②只有极性共价键的共价化合物是________________;
③既有离子键又有非极性键的化合物是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( )
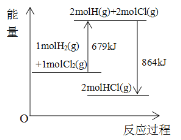
A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量
B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量
C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ
D. H2(g)+Cl2(g)→2HCl(g)+864kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中下列过程不涉及氧化还原反应的是 ( )
A.多吃水果(富含维生素C)美容养颜B.铝的表面生成致密的氧化薄膜
C.久置于空气中,浓硫酸的体积增大D.食品袋内装有还原铁粉的小袋防食品变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
△H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
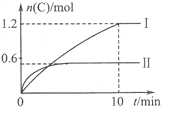
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
A. 实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B. 上述方程式中a=-160
C. 600℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com