
| 6.5g |
| 65g/mol |
| 161 |
| 287 |
| 161 |
| 287 |
| 161 |
| 287 |


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、浓硝酸和稀硝酸都具有强氧化性 |
| B、干燥的氯气无漂白性,液氯具有极强的漂白性 |
| C、火山喷发产生的火山灰中不可能含有SO3气体 |
| D、高温下SiO2与Na2CO3反应生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
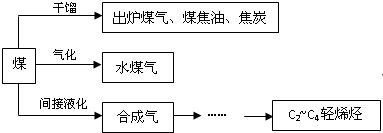
查看答案和解析>>
科目:高中化学 来源: 题型:
| 使用方法 | 开袋即食,或用微波炉加热1分钟后食用 |
| 部分配料 | ①小麦淀粉 ②棕榈油 ③食盐 ④柠檬黄 |
| 生产日期 | 见封口或喷码 |
| 保质期 | 12个月 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.
A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、可用KI淀粉试纸和食醋检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O═2HClO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1mol I2,反应中转移的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com