
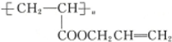 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. | 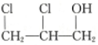 | D. | 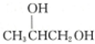 |
分析 先根据高聚物的结构简式 推断出其单体,然后采用逆推法:酯的水解得到醇和羧酸,最后根据醇的氧化反应原理将酯的水解产物加氢还原成该脂肪醇.
推断出其单体,然后采用逆推法:酯的水解得到醇和羧酸,最后根据醇的氧化反应原理将酯的水解产物加氢还原成该脂肪醇.
解答 解:结合加聚反应原理,该高聚物 的单体为:CH2=CH-COOCH2CH=CH2,经过酯的水解反应可以得到生成该酯的有机物为:CH2=CH-CH2-OH、CH2=CH-COOH,经过氧化生成丙烯酸的醇为:CH2=CH-CH2-OH,
的单体为:CH2=CH-COOCH2CH=CH2,经过酯的水解反应可以得到生成该酯的有机物为:CH2=CH-CH2-OH、CH2=CH-COOH,经过氧化生成丙烯酸的醇为:CH2=CH-CH2-OH,
所以这种脂肪醇为:CH2=CH-CH2-OH,
故选B.
点评 本题考查了根据高聚物推算单体的方法,题目难度中等,可以根据题中信息采用逆推法找出高聚物的单体,然后通过酯的水解、氧化反应得到脂肪醇的结构简式,要求学生把握好加聚反应、酯化反应、氧化反应的特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从柑桔中可提炼出苧烯(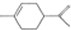 ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷(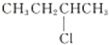 )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 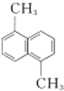 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、CCl4、酒精可用来萃取溴水中的溴 | |
| B. | 用激光笔鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 溶液 | 是否产生沉淀 | 沉淀成分 |
| ① | Ca(OH)2 | ||
| ② | BaCl2 | ||
| ③ | BaCl2和氨水 | ||
| ④ | BaCl2和氯水 | ||
| ⑤ | H2S | ||
| ⑥ | Ba(NO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com