
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
分析 加热时,醇自身可发生脱水反应生成醚,还可相互脱水生成醚,且二者均不能发生消去反应,以此来解答.
解答 解:A.2分子甲醇脱水可生成CH3-O-CH3,故A不选;
B.甲醇与(CH3)3C-CH2OH脱水可生成(CH3)3C-CH2-O-CH3,故B不选;
C.2分子(CH3)3C-CH2OH脱水可生成(CH3)3C-CH2-O-CH2-C(CH3)3,故C不选;
D.甲醇没有邻位C、(CH3)3C-CH2OH中与-OH相连C的邻位上没有H,则均不能发生消去反应生成烯烃,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意醇的性质及消去反应的结构特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
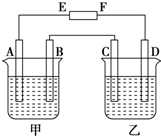 在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则查看答案和解析>>
科目:高中化学 来源: 题型:解答题
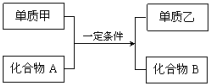 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com