
下列离子方程式正确的是 ( )
A.NH4HCO3溶液与过量NaOH溶液反应:NH 4++ OH―=NH3↑+ H2O
B.用惰性电极电解饱和氯化钠溶液:2Cl― + 2H +  H2↑+ Cl2↑
H2↑+ Cl2↑
C.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I― = 2Fe2++I2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32― + 6H+ + 2MnO4―=5SO4 2― + 2Mn2+ +3H2O
科目:高中化学 来源: 题型:
下列反应中,生成物的总能量大于反应物的总能量的是
A.氢气在空气中燃烧 B.氢氧化钡晶体与氯化铵晶体反应
C.盐酸与氨氧化钠溶液反应 D.锌与稀硫酸反应制取氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
 (1)硫酸生产过程中2SO2(g)+O2(g)
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据右图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据右图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
图1 图2 图3
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
②图3 中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0 若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
0 若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) 已知该反应的△H 0,简述该设想能否实现的依据: 。
0,简述该设想能否实现的依据: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 ( )
A.氯化硼液态时能导电而固态时不导电 B.氯化硼中心原子采用sp杂化
C.氯化硼分子呈正三角形,属非极性分子
D.其分子空间结构类似氯化磷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
查看答案和解析>>
科目:高中化学 来源: 题型:
I.设反应①Fe(s)+CO2(g) 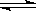 FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g) 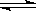 FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)现有反应③CO2(g)+H2(g) 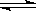 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g) 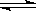 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g) 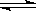 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_______ ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合,
则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.④⑤ B.①③ C.②③ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述中,正确的是
A.苯酚呈弱酸性,能使紫色石蕊试液显浅红色
B.苯酚能与FeCl3溶液反应生成紫色沉淀
C.苯酚有强腐蚀性,沾在皮肤上可用水洗涤
D.向少量苯酚溶液中滴加饱和溴水,可观察到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验,需要用水浴加热的有____________;用到了温度计的有__________。
A. 以苯为原料制备硝基苯 B. 溴乙烷的消去反应
C. 乙醛还原新制的氢氧化铜; D. 乙酸乙酯的制取
E. 石油的分馏 F. 葡萄糖的银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com