
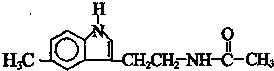 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,改变反应物的量,△H发生改变 | |
| B. | 上述反应生成1mol SO3,放热少于98.5KJ | |
| C. | 相同条件下加入2molSO2(g)、1mol O2(g) 充分反应放热等于197KJ | |
| D. | 相同条件下加入1molSO2(g)、0.5mol O2(g) 充分反应放热为Q1 kJ,若在相同容器中加入1mol SO3充分反应吸热等于Q2kJ,Q1kJ+Q2 kJ=98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
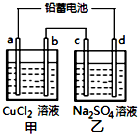 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
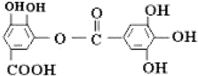
| A. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
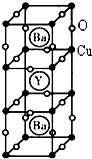 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com