
【题目】(1)对于下列反应:2SO2(g) + O2(g)![]() 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________; 若增大压强时,反应速度变化情况画在c~d处。
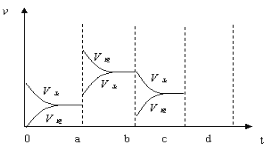
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将___________(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时____________(填“增大”、“减小”或“相等”)。
【答案】(1)2mol/(L·min) 2mol/L (2)升温 减小 SO3 浓度 (3)降低 减小
【解析】
试题分析:(1)根据v=△c/△t计算用SO2浓度变化来表示的化学反应速率为(6mol/L-2mol/L)/2min=2mol/(L·min);根据反应方程式的化学计量数关系可知v(SO2)=2v(O2)=2×0.5mol/(L·min)=1 mol/(L·min),2min后反应达平衡后SO2的浓度变化为2mol/L,那么2min时SO2的浓度为2mol/L。
(2)根据图像知a时刻,改变条件逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;b时刻正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物SO3的浓度;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为
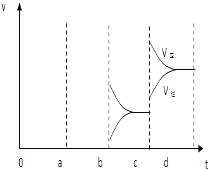 。
。
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍相当于减小压强,平衡向气体物质的量增大的逆向移动,由(2)分析知该反应正向为放热反应,达新平衡时,容器内温度将降低;达新平衡时,容器内气体的质量不变,气体的物质的量增大,容器内混合气体的平均相对分子质量比原平衡时减小。


科目:高中化学 来源: 题型:
【题目】下列生活中的化学小实验不合理的是( )
A. 在米汤中加入食盐,可以检验食盐中是否加碘
B. 用食用醋除去热水瓶中积存的水垢
C. 用纯碱溶液洗涤沾有油污的炊具
D. 用灼烧并闻气味的方法区分纯棉织物与纯毛织物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3 A(g)+B(g) ![]() 2 C(g)+x D(g),经2min后达到平衡状态,生成了2mol C,经测定D的浓度为0.5molL-1,下列判断正确的是( )
2 C(g)+x D(g),经2min后达到平衡状态,生成了2mol C,经测定D的浓度为0.5molL-1,下列判断正确的是( )
A.X = 3
B.A的转化率为50%
C.从反应开始到建立平衡,B的反应速率为0.5 molL-1min-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe-3e- = Fe3+
B.碱性介质甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH-
C.Mg — Al及NaOH溶液构成的原电池中负极材料为Mg
D.氯碱工业中阳极上产生的气体比阴极上产生的气体多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产的纯碱中常含有少量的NaCl杂质,某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数。
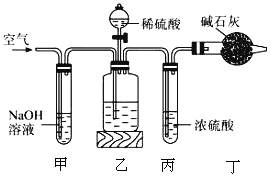
(1)甲装置反应的离子方程式是________________________。
(2)乙装置反应完成后,再通数分钟空气的作用是______________。
(3)若取ng样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为mg,实验结束后称得干燥管丁的总质量为wg,则Na2CO3质量分数的计算式为______________。
(4)若去掉丙装置,测得的CO2质量会______________(填“偏大”“偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2 (SO4)3、A12O3和Fe2O3,在一定条件下可实现下图所示的变化.
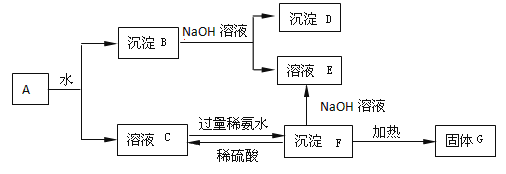
请回答下列问题:
(1)图中分离沉淀B与溶液C的方法是____________________。
(2)D、E、F这3种物质的化学式分别为:D:_______E:_______F:_________
(3)沉淀B与NaOH溶液反应的离子方式为__________;溶液C与过量稀氨水反应的离子方程式为_______________。
(4)检验溶液中是否含有Fe3+,最佳试剂是___________,现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是
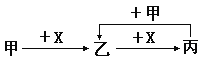
A.甲为c,X为O2 B.甲为SO2,X为NaOH溶液
C.甲为Al2O3,X为NaOH溶液 D.甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,X与强酸、强碱溶液反应如下,则下列说法正确的是( )
Y![]() X
X![]() Z.
Z.
A.若X为单质铝,则Y的气体产物只能是氢气
B.若X为NaHCO3,则Z一定有CO2
C.若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3
D.若X为乙酸乙酯,则生成物Y、Z中均含有乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com