
分析 由流程可知,①溶解,②中加NaOH除去镁离子,③中氯化钡可除去硫酸根离子,④中加碳酸钠可除去钡离子、钙离子,⑤过滤,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶⑦烘干得到NaCl.
(1)在粗盐提纯之前要先将粗盐溶解于水中,需烧杯、玻璃棒;
(2)③中加入氯化钡可除去硫酸根离子,钡离子过量,再加氯化钡不会生成沉淀;
(3)第④步中加入过量的Na2CO3去除钙离子以及多余的钡离子,形成碳酸钡、碳酸钙沉淀;
(4)碳酸钡、碳酸钙、氢氧化镁溶于盐酸,先用盐酸再进行操作⑤,影响制得精盐的纯度.
解答 解:(1)在粗盐提纯之前要先将粗盐溶解于水中,第①步操作是溶解,溶解需烧杯盛放粗盐、水,需玻璃棒搅拌加速溶解,
故答案为:溶解;烧杯、玻璃棒;
(2)②中加NaOH除去镁离子,③中氯化钡可除去硫酸根离子,④中加碳酸钠可除去钡离子、钙离子,BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为:取少量上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量,
故答案为:BaCl2;取少量上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
(3)第④步中加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(4)⑤过滤除掉碳酸钡、碳酸钙、氢氧化镁、硫酸钡沉淀,过滤后主要为氯化钠和碳酸钠,若先用盐酸调pH再过滤,生成的沉淀CaCO3、Mg(OH)2、BaCO3会溶解在盐酸中,从而影响精盐的纯度,
故答案为:若先加适量盐酸再过滤,生成的沉淀如CaCO3、Mg(OH)2、BaCO3会溶解在盐酸中,从而影响精盐的纯度.
点评 本题考查粗盐的提纯,把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的摩尔质量等于它的相对原子质量 | |
| B. | CH4的摩尔质量为16 g/mol | |
| C. | 22.4 L任何气体的物质的量均为1 mol | |
| D. | 1 mol 任何物质均含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
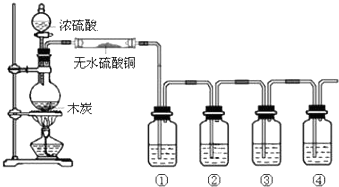
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
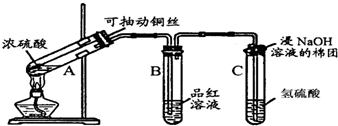
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
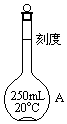 欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com