
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,负极附近溶液的pH降低 | |
| C. | 电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
分析 铁镍蓄电池放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,Ni2O3作正极,发生还原反应,最终生成Ni(OH)2,所以正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,据此分析判断.
解答 解:A.根据放电时总反应方程式知放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,所以电池的电解液应该为碱性溶液,Fe作负极,故A正确;
B.放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,消耗氢氧根离子,所以负极附近溶液的pH降低,故B正确;
C.根据反应电池放电时,正极上得电子发生还原反应,电极反应式为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,若外电路中有2mol电子转移,则内电路中有2molOH-移向负极,故C错误;
D.放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,故D正确;
故选C.
点评 本题考查电池的工作原理,涉及到原电池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的少
D.容器I中CO的转化率与容器II中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
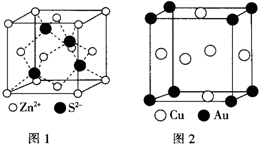
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 G在周期表的第七列 |
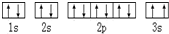 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L FeCl3溶液中所含Fe3+的数目为NA | |
| B. | 1mol NaHSO4晶体中所含离子的数目为2NA | |
| C. | 1mol NO2溶于足量水中,转移电子的数目为NA | |
| D. | 常温常压下,22.4L HCHO中所含σ键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 锌与稀硫酸反应时,加入少量NaHSO4固体时,可使反应速率加快 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 镀锌铁表面有划损时,仍然能阻止铁被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | SO2(乙炔) | 溴水 | 洗气 |
| B | 苯(溴) | KI溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | baecd | B. | edabc | C. | abdce | D. | ebadc |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com