
【题目】如图表示的一些物质或概念间的从属关系中不正确的是( )
![]()
A. X为含氧酸、Y为酸、Z为化合物
B. X为氧化物、Y为化合物、Z为纯净物
C. X为强碱、Y为碱、Z为化合物
D. X为非金属氧化物、Y为酸性氧化物、Z为氧化物
【答案】D
【解析】
A项,化合物可以分为酸、碱、盐、氧化物等,酸按是否含氧元素分为含氧酸和无氧酸;B项,纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等;C项,化合物可以分为酸、碱、盐、氧化物等,碱按电离程度不同分为强碱、中强碱、弱碱;D项,氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定是非金属氧化物如Mn2O7等,非金属氧化物也不一定是酸性氧化物如CO等。
A项,化合物可以分为酸、碱、盐、氧化物等,酸按是否含氧元素分为含氧酸和无氧酸,A项正确;B项,纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等,B项正确;C项,化合物可以分为酸、碱、盐、氧化物等,碱按电离程度不同分为强碱、中强碱、弱碱,C项正确;D项,氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定是非金属氧化物如Mn2O7等,非金属氧化物也不一定是酸性氧化物如CO等,酸性氧化物和非金属氧化物属于交叉关系,D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是___________,它的相对分子质量是___________,X的相对原子质量是__________,该物质的化学式__________。有一种气体的质量为14.2 g,体积是4.48 L(标准状况),该气体的摩尔质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成橡胶可以利用以下途径:
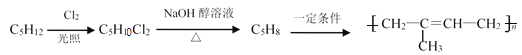
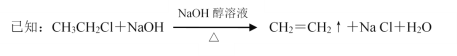
(1)C5H12同分异构体共有_____种,其中核磁共振H谱图只有1种的结构简式为________。
(2)下列有关上述的C5H8说法正确的是_____________。
A.所有的原子可能共平面 B.和溴水、溴的四氯化碳反应的现象不完全相同
C.所有C原子可能共平面 D.和溴的四氯化碳溶液反应生成产物最多有2种
(3)写出分子式C5H8属于炔烃的所有同分异构体的结构简式_____________________。
(4)写出下列反应的化学方程式(注明反应条件):
①C5H12→C5H10Cl2:_______________________________________________________。
②C5H10Cl2→C5H8:_____________________________________________________。
(5)以乙烷为原料可合成聚氯乙烯。请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:
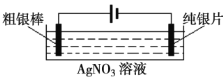
(1)阴极反应式为___________。
(2)精炼过程中,AgNO3溶液的浓度将___________(填“增大”、“减小”或“不变”);原因是___________。
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:
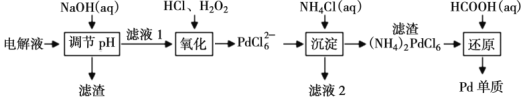
(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=___________,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为___________。
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法___________。
(6)写出“还原”步骤中发生反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
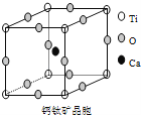
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__、__个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是__.该物质的化学式可表示为__。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛离子之间的距离)为dnm(1nm=10﹣9m),则该晶体的密度为__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4;
②AIN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)

连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为yg;称取xgAlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为amL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为____;若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为bmL(已知:该实验条件下的气体摩尔体积为VmL·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞__,打开活塞___,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为zg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2 Na2CO3·3 H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10 H2 O)、H2O2等为原料制备过碳酸钠的工艺流程如下:
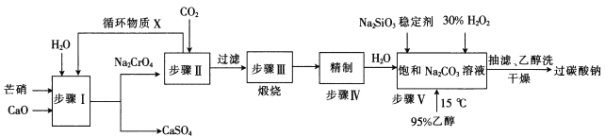
已知2CrO42-+2H+=Cr2O72-+H2O , pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。
回答下列问题:
(1)Na2CrO4中Cr元素的化合价为___
(2)Ksp(CaCrO4)___(填“>”或“<”)Ksp(CaSO4)。
(3)流程中循环物质X为___(填化学式)。
(4)步骤II中发生反应的化学方程式为_________
(5)步骤I一III是为了制得纯碱,从环境保护的角度看,可能的不足之处是___
(6)步骤V合成时,加入95%的乙醇的目的是___
(7)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①滴定到终点时,溶液呈___(填“无色”或“浅红色”)。
②过氧化物的活性氧是指过氧化物单独用催化剂催化分解时放出氧气的质量与样品的质量之比。该实验测得的产品中活性氧为___(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com