
��10�֣�ijʵ��С����0��50 mol��L-1NaOH��Һ��0��50 mol��L-1������Һ�����к��ȵIJⶨ��
������0��50 mol��L-1NaOH��Һ
��1����ʵ���д�ԼҪʹ��470 mL NaOH��Һ,������Ҫ����NaOH���� g��
��2����ͼ��ѡ�����NaOH��������Ҫ��������(����ĸ): ��
���� | ������ƽ | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
���� |
|
|
|
|
|
|
��� | a | b | c | d | e | f |
�ⶨ�к��ȣ���1��ʵ�����ϱ����ձ�(��С�����ձ�)����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ���Ͳ�����ᡢNaOH��Һ,��ȱ�ٵ�ʵ�鲣����Ʒ�� ��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ��,ʵ���������±���������д�±��еĿհ�:
ʵ�� ���� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ (t2-t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26��2 | 26��0 | 26��1 | 30��1 |
|
2 | 27��0 | 27��4 | 27��2 | 33��3 | |
3 | 25��9 | 25��9 | 25��9 | 29��8 | |
4 | 26��4 | 26��2 | 26��3 | 30��4 | |
�ڽ�����Ϊ0��50 mol��L-1NaOH��Һ��0��50 mol/L������Һ���ܶȶ���1 g/cm3,�кͺ�������Һ�ı�����c=��4��18��J/(g����)�����к��Ȧ�H= (ȡС�����һλ)��
������ʵ����ֵ�����57��3 kJ��mol-1��ƫ��,����ƫ���ԭ�������(����ĸ) ��
A��ʵ��װ�ñ��¡�����Ч���� B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��1��10��0������2��a��b��e �� ��1�����β�����������¶ȼƣ�
��2�� ��4��0����-53��5 kJ��mol-1����A��C��D��
��������
����������� ��1����ʵ���д�ԼҪʹ��0��50 mol/L�� 470 mL NaOH��Һ,��������ƿ�����������ӽ�����500ml������Ӧ��ѡ��500ml����ƿ�����ƣ���Һ�о�һ�ԣ�������Ũ����ȣ�����������Ҫ����NaOH�����������m(NaOH)=(0�� 5L��0��50 mol/L)��40g/mol=10��0g����2������NaOH��������Ҫ����������ҩ��ȡҩƷ������NaOH�и�ʴ�ԣ��������ձ���ʹ��������ƽ���г�������ѡ����a��b��e�� �ⶨ�к��ȣ���1��ʵ�����ϱ����ձ�(��С�����ձ�)����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ���Ͳ���ᡢNaOH��Һ,��ȱ�ٵ�ʵ�鲣����Ʒ�ǻ��β�����������¶ȼƣ���2���������Ĵ�ʵ���з�Ӧ���¶ȱ仯�ֱ��ǣ�5��6��1��3��9��4��1���ɼ���һ�Ρ��ڶ��ε����̫��ƫ����ʵֵ����ȥ��ƽ���¶��ǣ�3��9+4��1����2=4��0�������������Ƕ�Ԫ�ᣬNaOH��һԪ����Ը��ݸ�����Ũ������Һ�������֪���������Ӧ�ų�������Ӧ�ð��ռ������㣬���Ը÷�Ӧ���к��Ȧ�H=�� ��������ʵ����ֵ�����57��3 kJ��mol-1��ƫ��,����ƫ���ԭ�������A��ʵ��װ�ñ��¡�����Ч���ʹ����ɢʧ����ȷ�� B����ȡNaOH��Һ�����ʱ���Ӷ������������ʵ�������Ӧ�ų�������������C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У�ʱ�����������ɢʧ�Ķ࣬��ȷ��D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶ȣ�ʹ��Ӧ��ʼ���¶�ƫ�ߣ��¶Ȳ�ƫС����Ӧ��ƫ�٣���ȷ��
��������ʵ����ֵ�����57��3 kJ��mol-1��ƫ��,����ƫ���ԭ�������A��ʵ��װ�ñ��¡�����Ч���ʹ����ɢʧ����ȷ�� B����ȡNaOH��Һ�����ʱ���Ӷ������������ʵ�������Ӧ�ų�������������C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У�ʱ�����������ɢʧ�Ķ࣬��ȷ��D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶ȣ�ʹ��Ӧ��ʼ���¶�ƫ�ߣ��¶Ȳ�ƫС����Ӧ��ƫ�٣���ȷ��
���㣺�������ʵ���Ũ�ȵ���Һ�����ơ�����к��ȵIJⶨ���������������й�֪ʶ��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��2015��ӱ�ʡ��һ��һѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
(6��) Fe��Al�ֱ������ᷴӦ(������÷�����ʾ)��
��1�������������������ʵ�����Fe��Al����H2������֮��Ϊ_____________��
��2����������������������Fe��Al����H2������֮��Ϊ_________________��
��3����������������������Fe��Al����H2��ͬ��ͬѹ�µ������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ�� ��25�棩 | Ki=1.77��10-4 | Ki=4.9��10-10 | Ki1=4.3��10-7 Ki2=5.6��10-11 |
����ѡ��������
A��HCN+CO32- = CN-+ HCO3-
B��2HCOOH+CO32- = 2HCOO-+H2O+CO2��
C���к͵��������pH��HCOOH��HCN����NaOH����ǰ��С�ں���
D�����������Ũ�ȵ�HCOONa��NaCN��Һ��������������ǰ��С�ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ʵ���Ũ�ȵ�����������Һ����CH3COOH��(NH4)2CO3��NaHSO4��NaHCO3��Ba(OH)2����Һ��ˮ�ĵ���̶��ɴ�С������ȷ����
A���ݢۢ٢ܢ� B���ݢۢ٢ڢ�
C���ڢܢۢ٢� D���ڢܢ٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ����ʵ������ƽ���ƶ�ԭ�����͵���
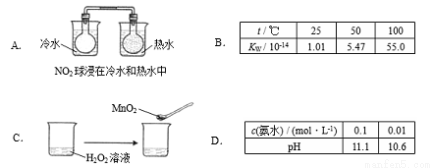
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�B�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ��е�λ������ͼ��ʾ����Yԭ�ӵ������������Ǵ�����������2��������˵������ȷ����(����)
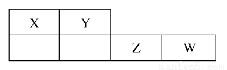
A���⻯���ȶ��ԣ�X>Y
B������������Ӧ��ˮ��������ԣ�W>Y
C��4��Ԫ�صĵ����У�W���ʵ��ۡ��е����
D�������W���ʾ���Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�B�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+(aq)+OH-(aq)=H2O��1�� �SH=��57��3kJ��mol����1L0��5mol��L��NaOH��Һ�м����������ʣ���ϡ���� ��Ũ���� ��ϡ���ᣬǡ����ȫ��Ӧʱ����ЧӦ�SH1���SH2���SH3�Ĺ�ϵ��ȷ���ǣ� ��
A���SH1>�SH2>�SH3 B���SH1<�SH3<�SH2 C���SH1<�SH2<�SH3 D���SH1>�SH3>�SH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�A�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӦmA(g)+ nB(g)  pC(g)+qD(g)����5min��ﵽƽ�⣬��ô�ʱA��Ũ�ȼ�����a mol/L��ͬʱC��Ũ��������2a/3 mol/L���ֲ��ƽ����Ӧ����v(C)=2v(B)���ﵽƽ����������¶Ȳ��䣬����ϵ��ѹ��ƽ�ⲻ�ƶ�����ô�÷�Ӧ�ɱ�ʾΪ�� ��
pC(g)+qD(g)����5min��ﵽƽ�⣬��ô�ʱA��Ũ�ȼ�����a mol/L��ͬʱC��Ũ��������2a/3 mol/L���ֲ��ƽ����Ӧ����v(C)=2v(B)���ﵽƽ����������¶Ȳ��䣬����ϵ��ѹ��ƽ�ⲻ�ƶ�����ô�÷�Ӧ�ɱ�ʾΪ�� ��
A��2A(g)+ 6B(g) 3C(g)+5D(g) B��3A(g)+ B(g)
3C(g)+5D(g) B��3A(g)+ B(g) 2C(g)+2D(g)
2C(g)+2D(g)
C��3A(g)+ B(g)  2C(g)+ D(g) D��A(g)+ 3B(g)
2C(g)+ D(g) D��A(g)+ 3B(g) 2C(g)+2D(g)
2C(g)+2D(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭����У9�������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
T ��ʱ��2L�ݻ�������ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z ��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y������ٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н��۴�����ǣ� ��
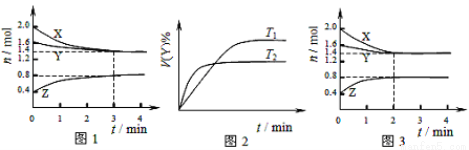
A�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)+Y(g)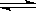 2Z(g)
2Z(g)
B��ͼ1 ��Ӧ����ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.1mol/(L��min)
C�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı��������ʹ�ô���
D�����������������䣬�����¶ȣ���ѧƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com