
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
分析 A.甲基中含有9个电子,1mol甲基中含有9mol电子;
B.标准状况下氯仿的状态不是气体;
C.乙烯和丙烯的最简式为CH2,根据最简式计算出混合气体的中含有的碳原子数目;
D.根据酯化反应是可逆反应进行判断.
解答 解:A.甲基的电子式为: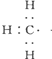 ,1mol甲基中含有9mol电子,含9NA个电子,故A错误;
,1mol甲基中含有9mol电子,含9NA个电子,故A错误;
B.在标准状况下氯仿不是气体,无法计算11.2L氯仿的物质的量,故B错误;
C.2.8g乙烯和丙烯的混合物中含有0.2mol最简式CH2,含有碳原子的物质的量为0.2mol,所含碳原子数为0.2NA,故C正确;
D.6.0g冰醋酸与4.6g乙醇发生酯化反应,应为酯化反应为可逆反应,所以生成乙酸乙酯的分子数小于0.1NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握阿伏伽德罗常数的概念,明确阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的关系,明确标况下气体摩尔体积的使用条件.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO- | |
| B. | 与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl- | |
| D. | 含Al3+的溶液:K+、Ca2+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com