某研究小组经查阅资料得知:2FeSO
4Fe
2O
3+SO
3↑+SO
2↑;FeSO
4FeO+SO
3↑,SO
3的熔点是16.8℃,沸点是44.8℃.
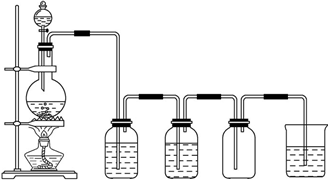
I.该小组探究在酒精喷灯加热条件下FeSO
4分解的气体产物,实验装置如图所示.
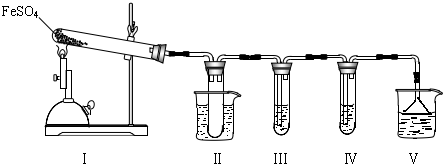
(1)装置Ⅱ的试管中不装任何试剂,其作用是
,试管浸泡在50℃的水浴中,目的是
.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol?L
-1 H
2SO
4溶液、6mol?L
-1 NaOH溶液、0.5mol?L
-1 BaCl
2溶液、0.5mol?L
-1 Ba(NO
3)
2溶液、0.01mol?L
-1酸性KMnO
4溶液、0.01mol?L
-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入 . | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入 . | |
Ⅱ.FeSO
4固体往往含有Fe
2(SO
4)
3杂质,该研究小组采用称重法确定固体中铁元素的质量分数,操作流程为:
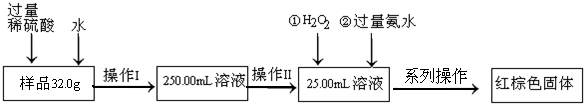
请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为
、
、
.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为
.





 阅读快车系列答案
阅读快车系列答案