
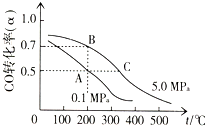
 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.| V |
| 22.4 |
| 10 |
| Va |
| 20 |
| Va |
| 5 |
| Va |
| 10 |
| Va |
| 5 |
| Va |
| 5 |
| Va |
| 10 |
| Va |
| 5 |
| Va |
| ||||
|
| Va2 |
| 100 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和氯气在光照条件下发生取代反应,产物是气体与液体的混合物 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、苯和乙烯都能使溴水层变为无色,二者都发生加成反应 |
| D、煤干馏可得煤油,甲烷、乙烯和苯都能从石油中分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
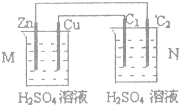
| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝热反应制取金属钨:WO3+2Al
| ||||
| B、红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)═Fe3O4+4H2 | ||||
| C、“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O | ||||
| D、在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+=I2+O2↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com