
| A. | n(Fe)<n(S),总质量等于44 g | B. | n(Fe)>n(S),总质量小于44 g | ||
| C. | n(Fe)=n(S),总质量大于44 g | D. | n(Fe)>n(S),总质量等于44 g |
分析 铁和硫加热1比1反应生成硫化亚铁:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,硫化亚铁与稀硫酸反应得到硫化氢,若铁过量,过量的铁与稀硫酸反应得到氢气,则气体的物质的量等于铁的物质的量,根据n=nM计算出铁的质量;然后分别根据n(Fe)=n(S)、n(Fe)>n(S)、n(Fe)<n(S)进行讨论得出答案.
解答 解:标准状况下11.2L气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
铁和硫加热1比1反应生成硫化亚铁,硫化亚铁与稀硫酸反应得到硫化氢,若铁过量,过量的铁与稀硫酸反应得到氢气,
则气体的物质的量等于铁的物质的量,则铁的物质量为0.5mol,质量为28g,
当n(Fe)>n(S)时,则S的物质的量小于0.5mol,原混合物总质量小于44g,故B正确;
当n(Fe)=n(S)时,S的物质的量为0.5mol,质量为16g,则原混合物总质量为44g,故C错误;
n(Fe)<n(S)时,S的物质的量大于0.5mol,质量大于16g,则总质量大于44g,故A、D错误;
故选B.
点评 本题考查了有关化学反应的计算,题目难度中等,明确反应原理并得出铁与气体的物质的量相等为解答关键,注意掌握铁与S反应生成的是氯化亚铁,试题培养了学生的化学计算能力.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
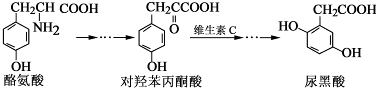
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中电子流出的一极为正极,发生氧化反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池中阴离子向负极移动 | |
| D. | 原电池正极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质在液态时能导电 | B. | 该物质在水溶液中能导电 | ||
| C. | 该物质能溶于水 | D. | 该物质具有较高的熔、沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com